Anatomische Grundlagen
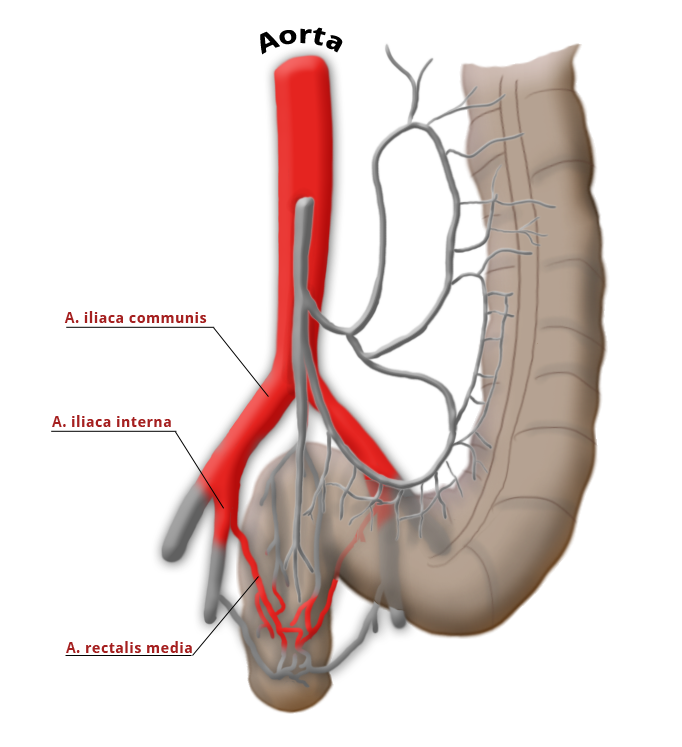
Die Arteria rectalis media ist nur in 20% der Fälle angelegt
Das Rektum liegt im kleinen Becken in enger Nachbarschaft zu den Samenblasen und der Prostata beim Mann sowie der Vagina und des Uterus bei der Frau. Die unteren zwei Drittel liegen extraperitoneal und sind dort von einem Fettkörper, dem Mesorektum umgeben. In ihm verlaufen die versorgenden Gefäße und Lymphbahnen.
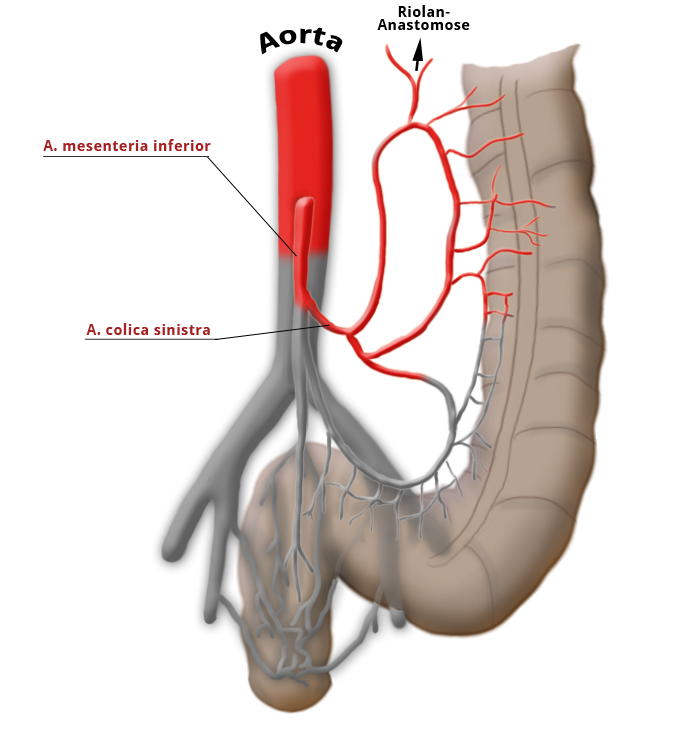
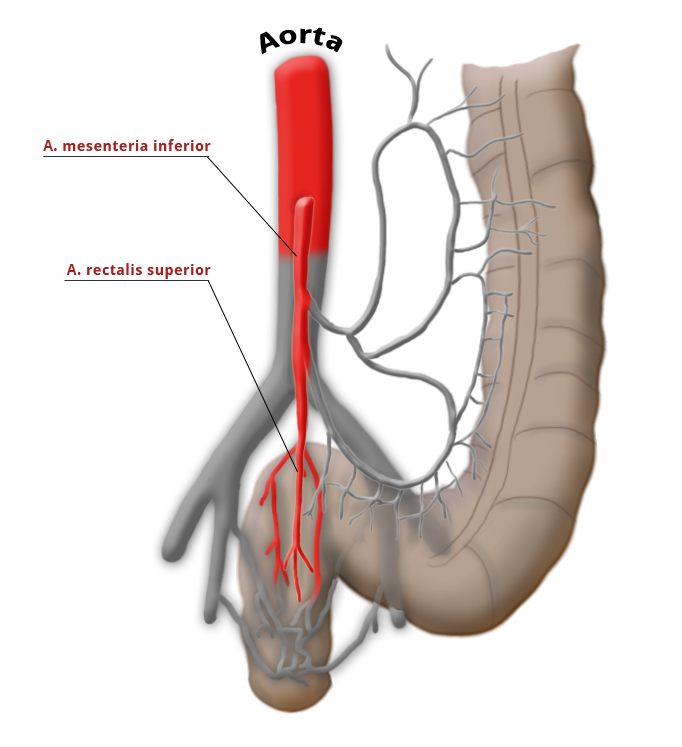
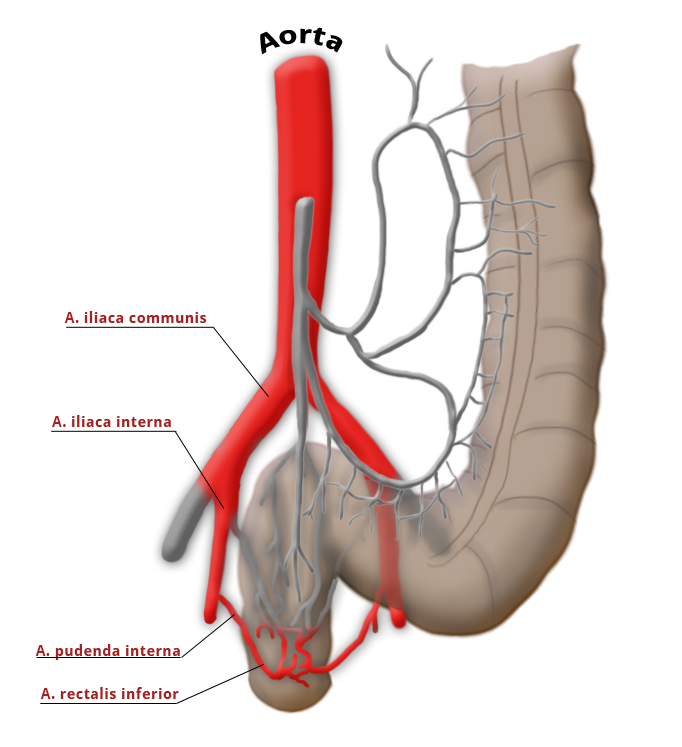
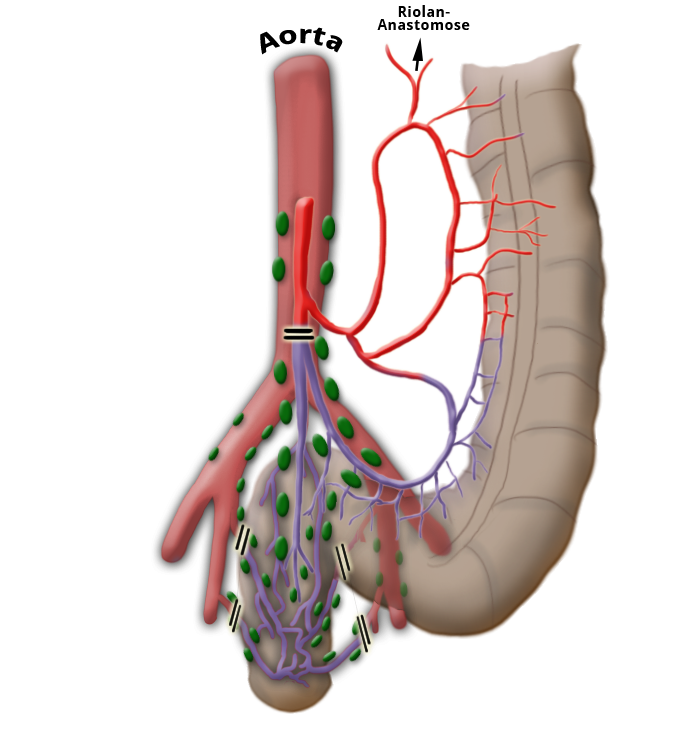
Die Gefäßversorgung des Rektums ist geteilt, dies geht auf die embryonale Entwicklung zurück. Der obere wird aus der A. mesenterica inferior über die A. rectalis superior versorgt. Der mittlere und untere Anteil wird über das Stromgebiet der A. iliaca intern versorgt. Die A. rectalis media ist nur in ca. 20% der Fälle ausgebildet. Der untere Anteil des Mastdarms wird über die A. rectalis inferior versorgt, die aus der A. pudenda interna entspringt. Diese kommt aus der A. ilica interna.
Arterielle Versorgung
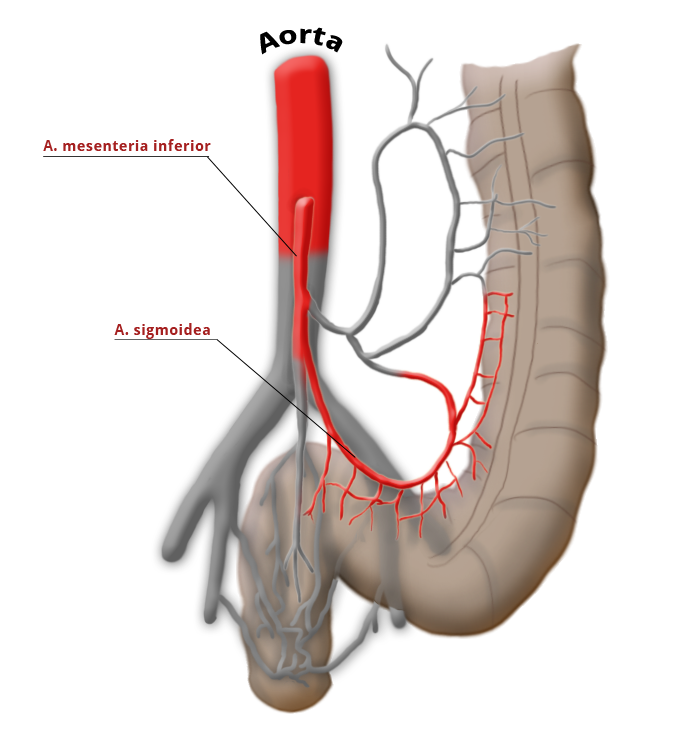
A. colica sinistra A. sigmoidea A. rectalis sup.
A. rectalis med. A. rectalis inf.
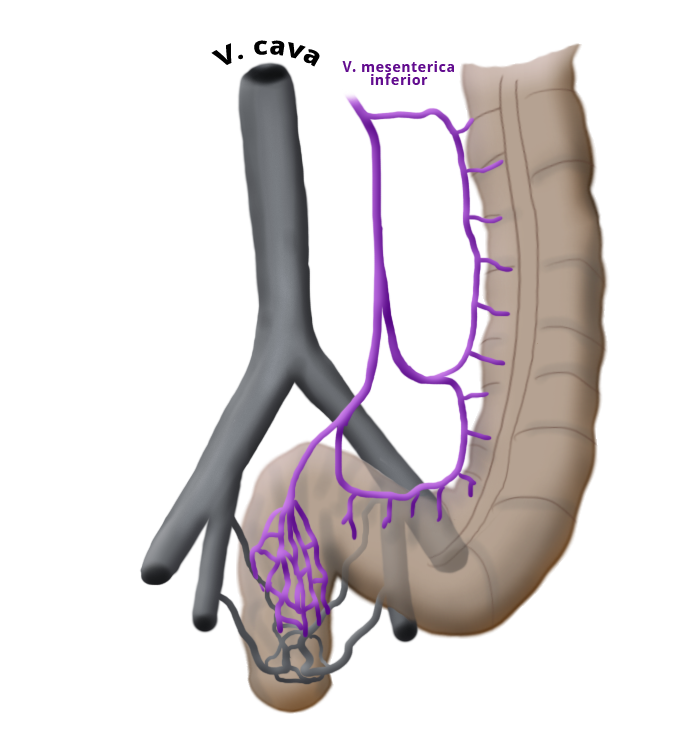
Venöser Abfluss
Venöser Abfluss Pfortadergebiet Cavales System
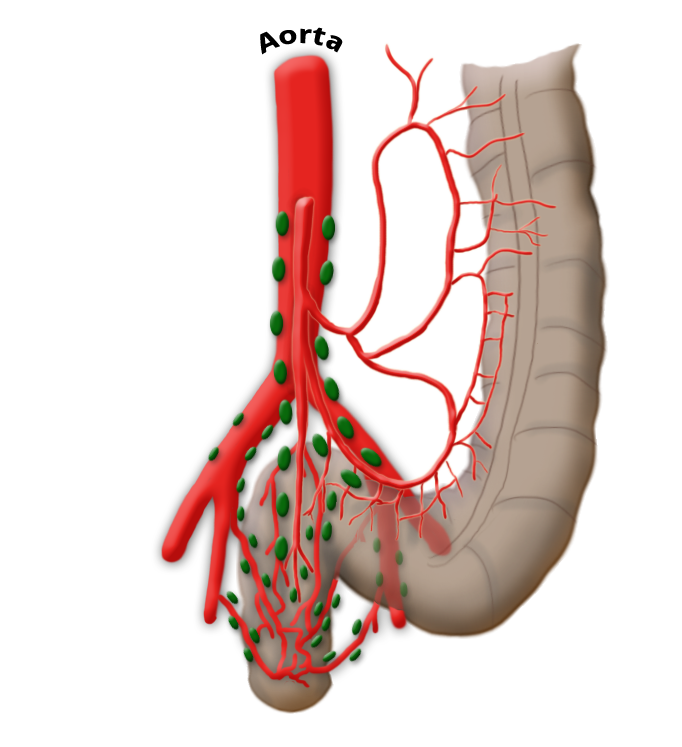
Lmyphknoten


Venöser Abfluss
Der venöse Abfluss ist ebenfalls geteilt, wobei sich am Rektum der portalvenöse mit dem cavalen Abflussgebiet überkreuzt, es besteht also funktionell eine portocavale Anastomose. Die unteren zwei Drittel drainiern direkt in die Vena cava, der obere Teil fließt über die Vena mesenterica inferior in den portocavalen Kreislauf ab.
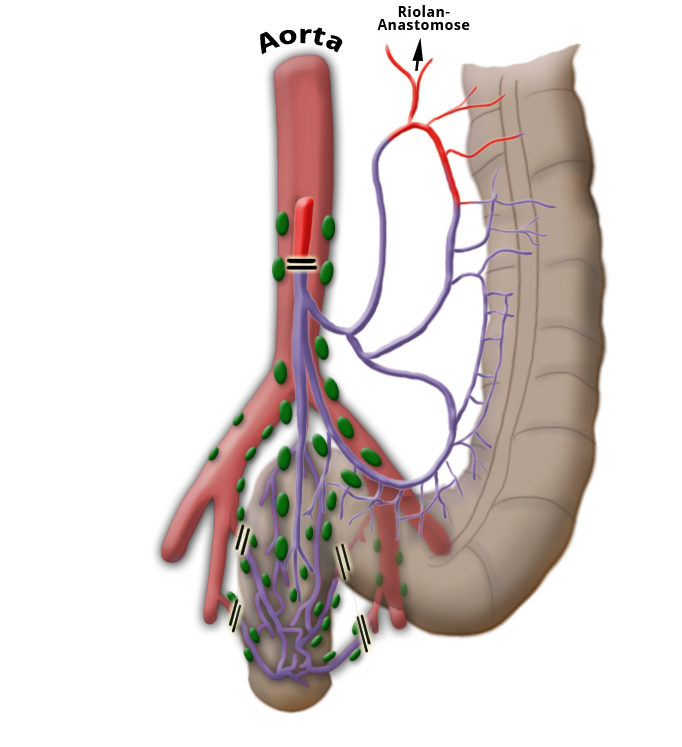
Die Lymphbahnen und Lymphknoten laufen entlang der arteriellen Gefäße. Das Ausmaß der Lymphadenektomie bestimmt bei der Operation das Ausmaß der Darmresektion. Damit alle Lymphknoten des Ablußgebietes entfernt werden, muss die A. mesenterica inferior nahe ihrem Abgang aus der Aorta unterbunden werden.
Ob dieser „high tie" Vorteile gegenüber dem „low tie“, also dem Absetzen auf Höhe der A. sigmoidea unter Belassung der A. colica sinistra Vorteile für das Gesamtüberleben oder die Rezidivfreiheit bringt, ist umstritten.1,2
Einleitung
Das Rektumkarzinom unterscheidet sich in wesentlichen Punkten vom Kolonkarzinom. Dies betrifft sowohl die Symptomatik und Klinik als auch ganz wesentlich die diagnostischen und therapeutischen Strategien. Zwei Drittel aller kolorektaler Karzinome sind im Rektum lokalisiert, etwa die Hälfte lässt sich mit einer überall und immer verfügbaren und wenig zeitaufwendigen Diagnostikmethode erfassen, die zudem auch sehr kosteneffizient ist: Mit dem Finger.
Die digital-rektale Untersuchung liefert ohne großen Aufwand bereits sehr viele Informationen über einen raumfordernden Prozess im Rektum. Dabei können Befunde bis ca. 8-10 cm von der Anokutanlinie erfasst werden. Neben der Größenausdehnung im Bezug auf das Lumen (z.B. semizirkulär substenosierend) kann der erfahrene Untersucher das Ausmaß der Verschieblichkeit gegenüber der Rektumwand einschätzen. Je verschieblicher der Befund ist, desto geringer ist die Eindringtiefe des Tumors.
Diese so genannte Mason-Klassifikation korreliert dabei erstaunlich gut mit der Gesamtprognose des Patienten.

Besonderem Stellenwert kommt beim Rektumkarzinom die Ausbreitungsdiagnostik zu, dem sog. Staging. Patienten mit lokal fortgeschrittenen Karzinomen profitieren von einer Vorbehandlung, die der radikalen Operation und Lymphadenektomie vorgeschaltet wird. Man spricht auch von einer neoadjuvanten Behandlung oder Neoadjuvanz. Die guten Ergebnisse einer neoadjuvanten Behandlung lassen sich durch eine alleinige Nachbehandlung nicht erreichen, daher ist es von essentieller Bedeutung für den Patienten, dass der Tumor so genau wie möglich präoperativ gestaged wird.3,4
Symptomatik
Jede Blutbeimengung im Stuhl ist verdächtig auf ein Karzinom!
Das Problem bei der Diagnostik der Rektumkarzinome ist, dass sie lange Zeit symptomlos bleiben. Alle Symptome, die auftreten können, sind Spätsymptome und Zeichen eines fortgeschrittenen Tumorwachstums.
Blutbeimengung im Stuhl ist immer verdächtig und sollte schlüssig abgeklärt werden, nötigenfalls auch mit einer Koloskopie. Mit der bloßen Verdachtsdiagnose „blutende Hämorrhoiden“ sollte man sich nie zufrieden geben. Veränderungen der Stuhlgewohnheiten können ebenso wegweisend ein, insbesondere bleistiftdünne Stühle oder der Wechsel von Verstopfung und Diarrhoe, auch paradoxe Diarrhoe genannt. Dieses Beschwerdebild wird durch einen stenosierenden Tumor verursacht, der zunächst eine Obstruktion bewirkt. Durch Gärungsprozesse kommt es zur Verflüssigung des Stuhls, so dass er sich teilweise explosionsartig entleert. Auch jede Störung der Kontinenz sollte zur diagnostischen Abklärung veranlassen. Patienten, die vom sog. „falschen Freund“ berichten, also unwillkürlicher Stuhlabgang beim Ablassen von Winden, weisen möglicherweise ein tiefsitzendes Rektumkarzinom auf, das die Feinkontinenz beeinträchtigt.
Diagnostik
Von entscheidender Bedeutung für die Therapie des Rektumkarzinoms ist die genaue Festlegung des prätherapeutischen Stadiums des Tumors, um den Patienten leitliniengerecht optimal behandeln zu können.
Digital rektale Untersuchung
Der erste Schritt dabei ist die digital rektale Untersuchung, in der neben der o.g. Mason-Klassifikation auch etwas über den Bezug zum Sphinktersystem und die Stärke des Sphinktertonus ausgesagt werden kann.
Koloskopie
Eine komplette Koloskopie gehört zum Standard-Repertoire der Diagnostik. Oft wird hier sogar – im Rahmen von Vorsorgekoloskopien – die Diagnose zufällig gestellt und der Befund histologisch gesichert. Bei der Darmspiegelung gilt es, ein gleichzeitig bestehendes Kolonkarzinom zu entdecken, man spricht auch vom synchronen Zweitkarzinom. Dies kann insbesondere bei hereditären Formen des kolorektalen Karzinoms auftreten. Gelingt die Koloskopie z.B. auf Grund eines stenosierend wachsenden Tumors nicht, so muss sie unbedingt postoperativ nachgeholt werden. Auch nach erfolgreicher Operation bei einem kolorektalen Karzinom sollte mindestens alle 3 Jahre eine Koloskopie erfolgen, um zeitversetzt auftretende Karzinome im Dickdarm (metachrone Zweikarzinome) auszuschließen.
Lokalisationsdiagnostik
Die Frage nach der Lokalisation des Rektumkarzinoms ist für den Patienten und auch den Operateur sehr wichtig. Der Abstand zum Sphinkterapparat bestimmt, ob ein Tumor kontinenzerhaltend operiert werden kann und hat somit entscheidenden Einfluss auf die Operationsstrategie. Da Rektumkarzinome meist direkt durch Wand des Rektums hindurchwachsen und sich longitudinal nicht sehr weit ausbreiten, ist ein Sicherheitsabstand von ca. 2 cm in der Regel ausreichend. Der Abstand zur Linea dentata sollte für eine kontinenzerhaltende Operation also im Idealfall mehr als 2 cm betragen.
Die Höhenangaben aus der flexiblen Endoskopie sind naturgemäß eher ungenau. Durch die Biegung des Koloskops kann sich leicht eine Ungenauigkeit von 10-20 cm einstellen, im oralen Teil des Kolons sogar noch wesentlich mehr. Eine verlässliche Lokalisationsdiagnostik ist daher mit der Koloskopie nicht zu erreichen.
Rektoskopie
Die Höhenlokalisation sollte daher immer mit einem starren Instrument gemessen werden, mit einem Rektoskop. Hiermit lasen sich sowohl Unter- und Oberrand des Tumors, also die Längsausdehnung, als auch der Abstand zur Linea dentata als Landmarke für die Schließmuskelebene präzise ausmessen.
Falls nicht bereits bei der Endoskopie geschehen, kann auch in der Rektoskopie eine Biopsie entnommen werden. Die Rektumschleimhaut ist schmerzunempfindlich, daher spürt der Patient von so einer Biopsie nur ein dumpfes Zwicken. Sehr gut innerviert und daher extrem schmerzempfindlich ist hingegen das Anoderm. Aus diesem Bereich sollte nur unter suffizienter Analgesie eine Biopsie entnommen werden.
mit freundlicher Genehmigung des Albertinen-Krankenhaus Hamburg
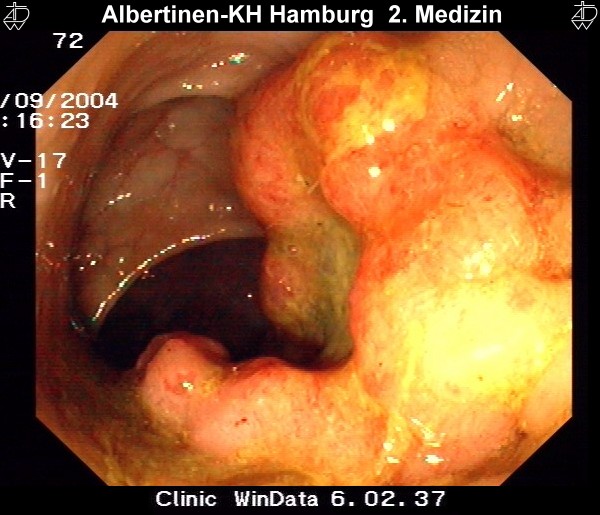
Koloskopie & Polypektomie
In diesem Patientenbeispiel wird eine endoskopische Polypektomie im Rektum bei einem sehr großen Polyp gezeigt. Da der Polyp aber sehr gut gestielt war, ließ er sich mit der Diathermieschlinge komplett abtragen, was im Histologieergebnis bestätigt wurde.
Nach der Abtragung wird der Polyp mit der Schlinge gefasst und nach transanal geborgen.
Endosonografie & MRT
Zur Einschätzung der Tiefeninfiltration und dem Befall lokoregionärer Lymphknoten eignet sich gleichermaßen die Endosonografie wie die Magnetresonanztomografie des Beckens. Bei der Sonografie wird ja immer betont, dass sie untersucherabhängig ist, was mit Sicherheit auch stimmt. Erfahrene Diagnostiker erreichen bei der Frage der Tiefeninfiltration eine Genauigkeit von 90%, beim Lymphknotenstaging immerhin noch 70%. Aber auch die MRT ist nicht unabhängig vom Untersucher, für ein gutes Resultat sind die Einstellungen des Gerätes und die verwendete Spule von entscheidender Bedeutung. Ein Aspekt, in der die Kernspinntomografie der Endosonografie überlegen ist, ist die Darstellung der pelvirektalen Hüllfaszien.
Der Abstand des Tumors zur Fascia pelvis visceralis ist prognostisch von Bedeutung und könnte in Zukunft die Entscheidung über eine neoadjuvante Vorbehandlung beeinflussen. Patienten bei denen dieser zirkumferentielle Abstand (engl. circumferential margin = CRM) 1 mm unterschreitet oder die pelvirektalen Faszien durchbrochen sind, haben auch nach optimaler Operation ein deutlich erhöhtes Rezidivrisiko. 5
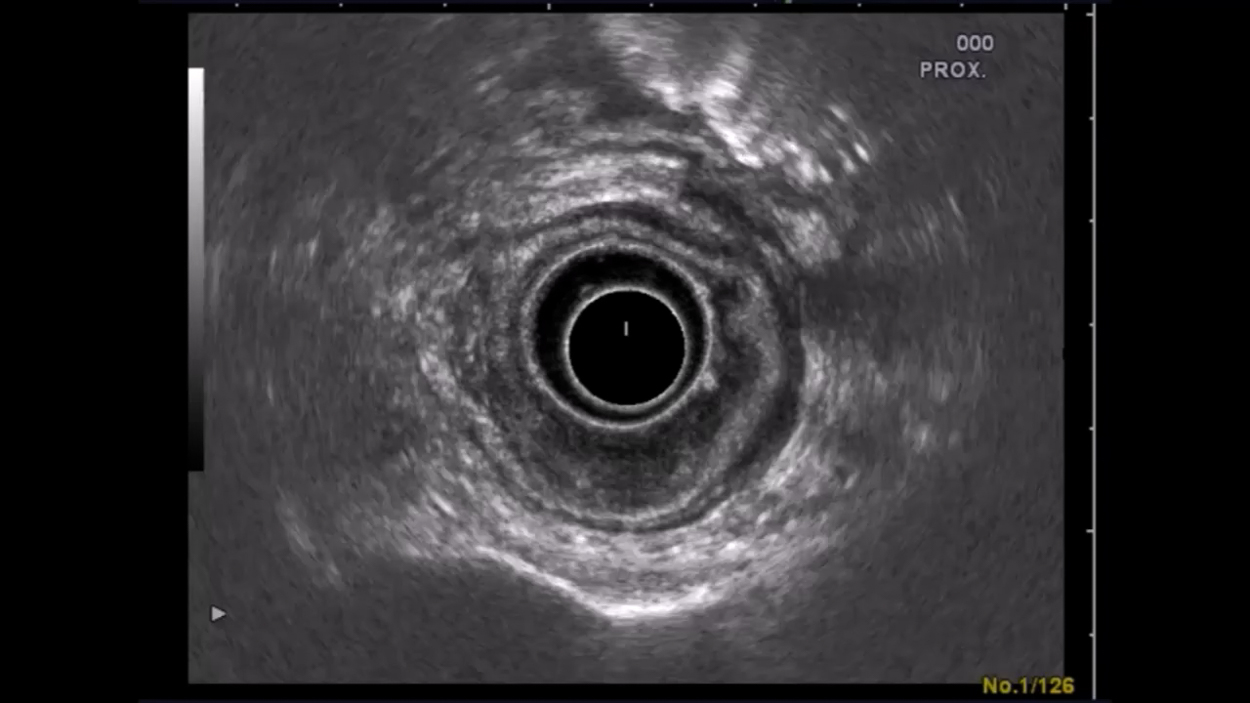
Endosonografiebeispiel
Bei diesem Patienten liegt ein lokal fortgeschrittenes Rektumkarzinom im Stadium uT3 uN+ vor. In der Endosonografie kann man die normale 5-Schichtung des Rektums sehen, die aus den Wandschichten und den sonografischen Grenzflächen besteht. Bei 5-6 Uhr SSL ist eine Raumforderung zu erkennen, die diese Wandschichtung aufhebt. Gut zu sehen ist, wie die äußere echoarme Schicht, die die Serosa repräsentiert, durchbrochen wird.
Endosonografie
In der Endosonografie kann man besonders gut die Ausbreitung des Tumors über die Wanschichten des Rektums sehen. Normalerweise sieht man fünf Sichten in der Sonografie, den Wandschichten des Rektums entsprechend incl. der sonografischen Grenzschichten. Auch vergrößerte Lymphknoten sind leicht zu erkennen, wobei dies über die Dignität natürlich nichts aussagt. Auch entzündliche Lymphknoten sind vergrößert, vor allem einige Tage nach einer Biopsie. Dennoch ist jeder vergrößerte LK verdächtig auf eine Metastase und wird dementsprechend als uN+ gewertet. Tumor uT3 Lymphknoten uN+Einteilung
Ursprünglich wurden die Rektum-Karzinome nach der DUKES-Klassifikation eingeteilt, die auf das Jahr 1932 zurückgeht.
In Europa hat diese Einteilung ihre klinische Bedeutung verloren. Die gängigste Einteilung ist die UICC-Einteilung, die sich an der TNM-Klassifikation orientiert.
TNM 7 2009 – deutsche Auflage 2010
CT Thorax/Abdomen
Die Frage nach Fernmetastasen lässt sich am ehesten mit einer Computertomografie des Thorax und des Abdomens beantworten. Der Hauptlymphabfluss geht über das portocavale Venensystem über Vena mesenterica inferior. Der untere Anteil des rektalen Venenplexus drainiert aber direkt in die Vena cava und kann damit das Stromgebiet der Leber umgehen. Dies ist nicht nur ein Grund, warum rektal applizierte Medikamente schnell anfluten, in dem sie den „first pass effect“ der Leber umgehen, es ist auch der Grund, warum bei einem Rektumkarzinom zuerst Lungenmetastasen auftreten können.
Nach den gültigen Leitlinien ist auch eine Sonografie des Abdomens und ein Röntgen-Thorax-Bild ausreichend für das Staging eines Rektumkarzinoms, allerdings ist die CT mittlerweile beinahe überall kostengünstig verfügbar und der mögliche Strahlenschaden im Vergleich zu übersehenen Metastasen als nachranging anzusehen.
Tumormarker
Die Abnahme des Tumormarkers CEA dient vor der Operation zur Bestimmung eines Ausgangswertes. Fällt dieser Wert nach einer R0-Resektion ab, so kann ein erneuter Anstieg auf ein Rezidiv oder eine Metastasierung hinweisen. Als Screeningparameter ist das CEA ungeeignet.
Staging
Ein präzises Staging ist die Grundlage für eine leitliniengerechte Therapie. Das Ziel der Chirurgie des Rektumkarzinoms ist die radikale Entfernung des Tumors unter Einhaltung eines ausreichenden Sicherheitsabstandes. Bei gut differenzierten Tumoren sind hierfür 2 cm ausreichend, bei schlechter differenzierten Tumoren sollte ein höherer Sicherheitsabstand eingehalten werden.
Ein weiteres wichtiges onkologisches Grundprinzip ist die komplette Entfernung der lokoregionären Lymphknoten. Da die Lymphknoten entlang der Arterien verlaufen, wird hierfür die A. mesenterica inferior abgesetzt. Umstritten ist dabei, ob eine stammnahe Ligatur an der Aorta einen Vorteil gegenüber eine Ligatur nach Abgang der A. colica sinistra bringt.1,2
Das Ausmaß der Darmresektion wird durch die Durchblutungssituation nach der Lymphadenektomie bestimmt
Bei dem sog. „high tie“, also dem stammnahen Absetzen der A. mesenterica inferior muss der Resektionsrand am Kolon nahe der linken Flexur gewählt werden, weil der darunterliegende Darm durch das Unterbinden der A. colica sinistra ischämisch wird. Die Durchblutungssituation nach der radikalen Lymphadenektomie bestimmt also das Resektionsausmaß am Darm, welches ja weit über den unmittelbar geforderten Sicherheitsabstand von 2 cm hinausgeht.

"high-tie" - Absetzen auf Höhe der A. mesenterica inferior

"low-tie" - Absetzen auf Höhe der A. sigmoidea
Neoadjuvante Vorbehandlung
Die Höhenlokalisation spielt bei der Wahl der Operationsstrategie eine entscheidende Rolle. Tumoren im oberen Drittel des Rektums werden vom Prinzip wie Kolonkarzinome behandelt, d.h. eine neoadjuvante Therapie wird in aller Regel nicht durchgeführt, sondern die Karzinome primär reseziert. Obligater Bestandteil ist dabei die partielle mesorektale Exzision oder PME.
Im mittleren und unteren Drittel lokalisierte Tumoren werden in fortgeschrittenen Stadien neoadjuvant vorbehandelt. Kriterien für eine solche Vorbehandlung ist ein T-Stadium >=3 bzw. der V.a. Lymphknotenmetastasen. Ein Karzinom mit prätherapeutischem Staging von uT3 uN0 würde also ebenso vorbehandelt werden wie ein Tumor mit der Formel uT2 uN+. Das Präfix „u“ steht dabei für ultrasound und ist die gängige Abkürzung für das Staging, welches präoperativ erhoben wurde.
Das definitive Staging wird mit einem „p“ für Pathologie begonnen und um ein „y“ ergänzt, wenn es sich um einen neoadjuvant vorbehandelten Tumor handelt. Ein „ypT2 ypN0 (0/15) M0 G2 R0“ Tumor wäre also bis in die Submukosa infiltriert, neoadjuvant vorbehandelt und ohne befallene Lymphknoten komplett entfernt worden. In diesem Falle sind 15 Lymphknoten vom Pathologen gefunden worden, die Mindestanzahl an untersuchten Lymphknoten sollte 12 betragen, um eine sichere Aussage über den N-Status eines Tumors machen zu können.
Das Ziel einer neoadjuvanten Vorbehandlung ist zum einen die Verkleinerung des Tumors im Sinne eines Downsizing, aber auch ein Downstaging soll erfolgen, also die Reduktion der Eindringtiefe.
So lassen sich mehr Tumoren kontinenzerhaltend resezieren bei gleichzeitiger Schonung der wichtigen Nervenplexus im kleinen Becken. Das Gesamtüberleben der Patienten wird durch eine neoadjuvante Vorbehandlung nicht beeinflusst. Dies ist in der Regel durch die Fernmetastasierung limitiert. Darauf hat die Neoadjuvanz keinen Einfluss, wohl aber auf die Wahrscheinlichkeit eines Lokalrezidivs. Lokalrezidive eines Rektumkarzinoms sind schwer zu behandeln und verschlechtern auf Grund lokaler Komplikationen die Lebensqualität der Patienten deutlich.
Langzeitradiochemotherapie vs. Kurzzeitradiatio
Im Moment lassen sich zwei unterschiedliche Therapieprinzipien in der Neoadjuvanz unterscheiden. Zum einen die Kurzzeitradiatio über eine Woche mit unmittelbar nachgeschalteter Operation. Zum anderen die Langzeitradiochemotherapie über 6 Wochen, bei der zu Beginn die Bestrahlung durch eine Chemotherapie mit 5-Fluoruracil (5-FU) unterstützt wird.
Das 5-FU wirkt dabei als Radiosensitzer, es verstärkt die Empfindlichkeit der Zellen für die Bestrahlung. Nach dieser Langzeitradiochemotherapie wird eine Pause von 6 Wochen vor der Operation eingehalten. Die Morbidität einer Rektumresektion ist nach Neoadjuvanz erhöht, jedoch überwiegen die Vorteile für den Patienten die Nachteile der Therapie. Zur Wahl des neoadjuvanten Vorgehens heißt es in der S3-Leitline zum kolorektalen Karzinom:
In Situationen, in denen ein Downsizing angestrebt wird (T4-Tumore, nicht ausreichender Sicherheitsabstand im Dünnschicht- MRT zur mesorektalen Faszie – Abstand 1 mm oder weniger – oder erwünschter Sphinkterhalt bei Tumoren im unteren Drittel), soll der präoperativen Radiochemotherapie der Vorzug vor einer Kurzzeit-Radiotherapie gegeben werden. Bei cT3-Tumoren oder cN+-Tumoren, bei denen kein Downsizing angestrebt wird, kann die präoperative Therapie entweder als Radiochemotherapie oder als Kurzzeitbestrahlung erfolgen.
Eine postoperative Radiochemotherapie bei initial unterschätztem Befund bringt schlechtere Ergebnisse bzgl. des Lokalrezidivs bei gleichzeitig deutlich erhöhter Komplikationsrate nach der Operation. 6
Nach neoadjuvant erfolgter Radiochemotherapie sollte unabhängig vom postoperativen Tumorstadium nach einer radikalen Operation ergänzend eine adjuvante Chemotherapie erfolgen, da dies das Gesamtüberleben der Patienten und das tumorfreie Überleben verbessert.7
Die Therapie jedes Patienten mit Rektumkarzinoms wird im Rahmen eines interdisziplinären Tumorboards festgelegt. Daran nehmen Gastroenterologen, Onkologen, Chirurgen, Strahlentherapeuten, Radiologen, Pathologen und Gynäkologen teil.
Chirurgie des Rektumkarzinoms
Man unterscheidet zwischen der anterioren Rektumresektion für Tumore des oberen Drittels und der tief anterioren Resektion bei Tumoren des mittleren und unteren Drittels. Die Rekonstruktion der Passage erfolgt dabei in der Regel mit einer maschinell durchgeführten Descendo-Rektostomie.
Dazu wird oft ein zirkuläres Klammernahtgerät verwendet, das gleichzeitig klammern und schneiden kann und so die Anastomose zwischen den Darmabschnitten herstellt.
Das Rektum hat im Gegensatz zum Kolon keine Taenien und daher auch keine gerichtete Peristaltik. Vielmehr dient es als Reservoir für den Stuhl und gibt sensorische Rückmeldung in Form von Stuhldrang. Nach der Resektion geht diese Funktion zumindest zum Teil verloren. Um die Peristaltikwelle des Descendes zu unterbrechen und nicht direkt auf den Rest des Rektums und den Sphinkterapparat treffen zu lassen, wird in den meisten Fällen ein Pouch angelegt. Dieser dient in gewissem Maße auch als neu geschaffenes Reservoir. Die gängigsten Methoden sind dabei ein J-Pouch oder ein Coloplastiepouch.
Je tiefer die Anastomose zu Liegen kommt, desto grenzwertiger wird die Durchblutung. Somit steigt die Gefahr einer postoperativen Anastomoseninsuffizienz mit der Folge einer Beckenphlegmone und Sepsis. Daher sollte bei einer tief anterioren Rektumresektion immer ein Schutzileostoma angelegt werden. Dieser verhindert zwar nicht das Auftreten einer Insuffizienz, schließlich ändert es nichts an den Durchblutungsverhältnissen. Aber die Folgen einer Insuffizienz sind wesentlich weniger dramatisch, wenn der Darm deviiert wurde.
Möglicherweise verläuft dadurch eine ganze Anzahl an kleinen Anastomoseninsuffizienzen klinisch so inapparent, dass sie gar nicht diagnostiziert werden. Vor der Rückverlagerung eines Ileostomas muss daher immer sichergestellt werden, dass keine Insuffizienz besteht oder eine Stenose der Anastomose vorliegt.
Bei sehr tief sitzenden Karzinomen kann es notwendig werden, eine abdomino-perineale Rektumresektion durchzuführen, wobei der Anus mitreseziert und das Colon descendens als endständiges Descendostoma ausgleitet wird.
Auch intersphinktäre Resektionen, also die abdomino-peranale Resektion sind möglich. Die dabei notwendig werdende Handnahtanastomose auf Sphinkterniveau erfordert aber viel operative Erfahrung.
Bei initial schlechter Sphinkterfunktion und eingeschränkter Kontinenz ist der abdominoperinealen Resektion mit endständigem Kolostoma der Vorzug zu geben, da eine gute Stomaversorgung eine bessere Lebensqualität und eine günstigere pflegerische Situation bietet als eine ständige Inkontinenz.
Lokal limitierte Resektionsverfahren sind unter ganz engen Indikationskriterien ebenfalls möglich. Wenn es sich nachweislich um einen T1-Tumor handelt, der maximal 3 cm groß ist und eine gute bis mäßige Differenzierung aufweist, kann eine transanale Vollwandresektion erfolgen ohne radikale Lymphadenektomie.
Natürlich dürfen keine Lymphknoten als verdächtig gestaged werden, ansonsten verbietet sich diese Vorgehen. Histologisch muss die komplette Entfernung bestätigt werden, ansonsten ist eine Nachresektion im Sinne einer radikalen Operation notwendig. Bei T2-Karzinomen darf diese Methode auch nicht mehr zur Anwendung kommen, da 10-20% dieser Tumoren bereits lymphatisch metastasiert sind.
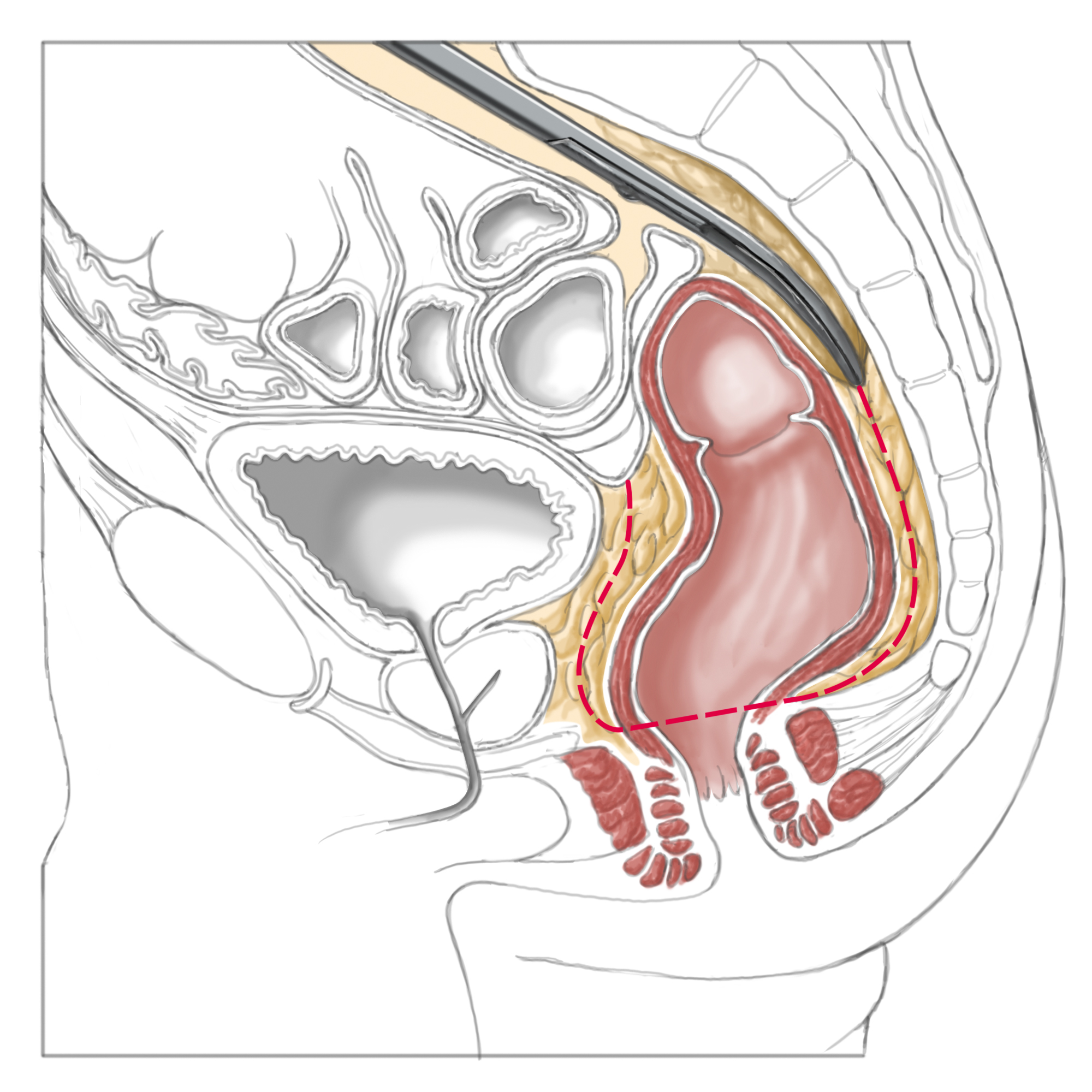
Total mesorektale Exzision
Das Rektum liegt zu zwei Dritteln extraperitoneal und ist in diesem Bereich von einem Fettkörper umgeben, der die Lymphknoten und die Gefäßversorgung enthält. Dieser Fettkörper wird von den pelvinen Faszien umhüllt, die ihn ovalär umgeben.
Zwischen diesen Faszien, der fascia pelvis visceralis und fascia pelvis parietalis liegt eine sehr gefäßarme Schicht, in der optimaler Weise die Präparation erfolgt. Somit vermeidet man Blutungen, die bei einer tubulären, also nahe dem Rektum erfolgenden Präparation auftreten würden.
Viel wichtiger ist jedoch die Mitentfernung des sog. mesorektalen Fettkörpers oder Mesorektums mit samt den darin enthaltenen lokoregionären Lymphknoten.
Dieser Operationsschritt heißt „totale mesorektale Exzision“ oder „partielle mesorektale Exzision“, je nach der Höhe des zu entfernenden Rektumkarzinoms. Im engeren anatomischen Sinne ist das Mesorektum kein Meso, da es sich dabei nicht um eine Dopplung des Peritoneums handelt, in dem organversorgende Gefäße ziehen. Der Begriff hat sich dennoch international so eingebürgert. Das Konzept der TME wurde vor über 20 Jahren durch RJ Heald eingeführt.3
Entscheidend für die Qualität der Resketion ist die komplette Entfernung des mesorektalen Fettkörpers, ohne diesen nach distal konisch herauszupräparieren. Dieses “Coning” würde mögliche Lymphknotenmetastasen zurücklassen und die Prognose für den Patienten verschlechtern.
Die Güte der mesorektalen Exzision wird durch den Pathologen nach der M.E.R.C.U.R.Y.-Klassifikation in drei Grade eingeteil: good (1), intermediate (2) und poor (3).
Literatur
- Survival after high or low ligation of the inferior mesenteric artery during curative surgery for rectal cancer.Ann Surg. 1984 Dec;200(6):729-33.: Pezim ME, Nicholls RJ.
- Effect of high and intermediate ligation on survival and recurrence rates following curative resection of colorectal cancer.Dis Colon Rectum. 1997 Oct;40(10):1205-18; discussion 1218-9.: Slanetz CA Jr1, Grimson R.
- Preoperative versus postoperative chemoradiotherapy for rectal cancer.N Engl J Med. 2004 Oct 21;351(17):1731-40.:
- Adjuvant vs. neoadjuvant radiochemotherapy for locally advanced rectal cancer: the German trial CAO/ARO/AIO-94.Colorectal Dis. 2003 Sep;5(5):406-15.Sauer R1, Fietkau R, Wittekind C, Rödel C, Martus P, Hohenberger W, Tschmelitsch J, Sabitzer H, Karstens JH, Becker H, Hess C, Raab R; German Rectal Cancer Group.
- Rectal carcinoma: is too much neoadjuvant therapy performed? Proposals for a more selective MRI based indicationZentralbl Chir. 2006 Aug;131(4):275-84.: Junginger T1, Hermanek P, Oberholzer K, Schmidberger H.Junginger T1, Hermanek P, Oberholzer K, Schmidberger H.
- Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial.Lancet. 2009 Mar 7;373(9666):811-20. doi: 10.1016/S0140-6736(09)60484-0.Sebag-Montefiore D1, Stephens RJ, Steele R, Monson J, Grieve R, Khanna S, Quirke P, Couture J, de Metz C, Myint AS, Bessell E, Griffiths G, Thompson LC, Parmar M.
- Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med. 2006 Sep 14;355(11):1114-23.Bosset JF1, Collette L, Calais G, Mineur L, Maingon P, Radosevic-Jelic L, Daban A, Bardet E, Beny A, Ollier JC; EORTC Radiotherapy Group Trial 22921.

 Wunde, Wundheilung
Wunde, Wundheilung Infektion
Infektion Akutes Abdomen
Akutes Abdomen Abdominaltrauma
Abdominaltrauma Ileus
Ileus Hernien
Hernien Struma benigna
Struma benigna Schilddrüsen-CA
Schilddrüsen-CA Nebenschilddrüsen
Nebenschilddrüsen Hypderthyreose
Hypderthyreose Nebenniere
Nebenniere Achalasie
Achalasie Ösophagus-CA
Ösophagus-CA Ösophagusdivertikel
Ösophagusdivertikel Ösophagusperforation
Ösophagusperforation Verätzung
Verätzung Magen-CA
Magen-CA Ulkuskrankheit
Ulkuskrankheit GERD
GERD Adipositas
Adipositas CED
CED Divertikulitis
Divertikulitis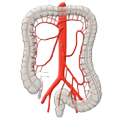 Kolon-CA
Kolon-CA Proktologie
Proktologie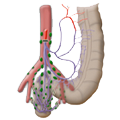 Rektum-CA
Rektum-CA Aantomie
Aantomie Ikterus
Ikterus Cholezystolithiais
Cholezystolithiais Benigne Leberläsionen
Benigne Leberläsionen Maligne Leberläsionen
Maligne Leberläsionen Pankreatitis
Pankreatitis Pankreaskarzinom
Pankreaskarzinom