Einteilung
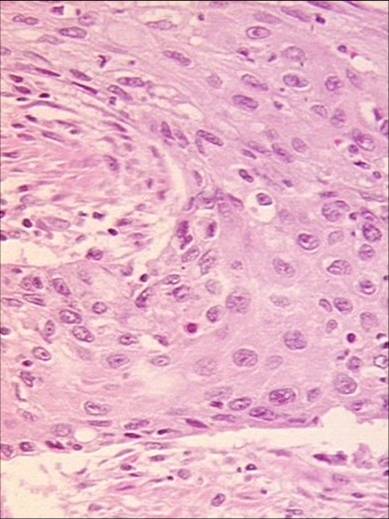
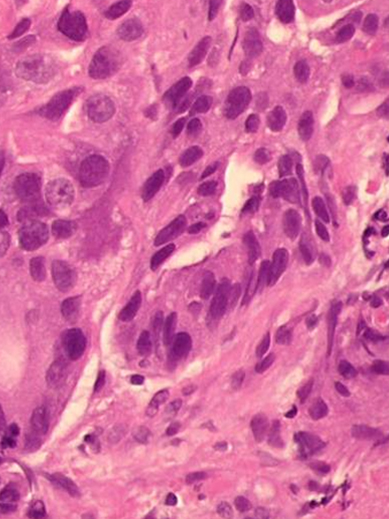
Bei den malignen epithelialen Tumoren der Speiseröhre kann man histologisch zwei Haupt-Typen unterscheiden: Das Plattenepithelkarinzom und das Adenokarzinom. Diese beiden Entitäten unterscheiden sich hinsichtlich ihrer Ätiologie, Pathogenese und Lokalisation. Häufiger ist das Plattenepithel-CA, allerdings nimm die Inzidenz der Adenokarzinome vor allem in den westlichen Ländern dramatisch zu. Wesentlich seltener sind mesenchymale Tumore wie das Leiomysarkom.
Die Prognose ist insgesamt ungünstig, da viele Karzinome bereits bei Diagnosestellung lymphogen metastasiert sind. Dies wird durch die sehr gute lymphatische Drainage des Ösophagus begünstigt. Das bedeutet, dass bereits ab einer sehr geringen Eindringtiefe des Tumors in die Wandschichten des Ösophagus die Wahrscheinlichkeit von befallenen Lymphknoten steigt. Eine unmittelbare Auswirkung hat dies natürlich auf die Gesamtprognose und die Durchführbarkeit lokal limitierter Resektionsverfahen, bei denen nur die Mukosa abgetragen wird und die Lymphknoten nicht mitreseziert werden.
Lokalisation
Die Speiseröhre ist normalerweise mit Platteneptihel ausgekleidet, im Gegensatz zum Zylinderepithel des Magens. Somit können Plattenepithelkarzinome auch auf der gesamten Länge des Ösophagus auftreten.
Häufig wachsen die Plattenepithelkarzinome auch multifokal an mehreren Stellen der Speiseröhre. Dies betrifft bis zu 15% der Tumore, Adenokarzinome wachsen praktisch nie multizentrisch.
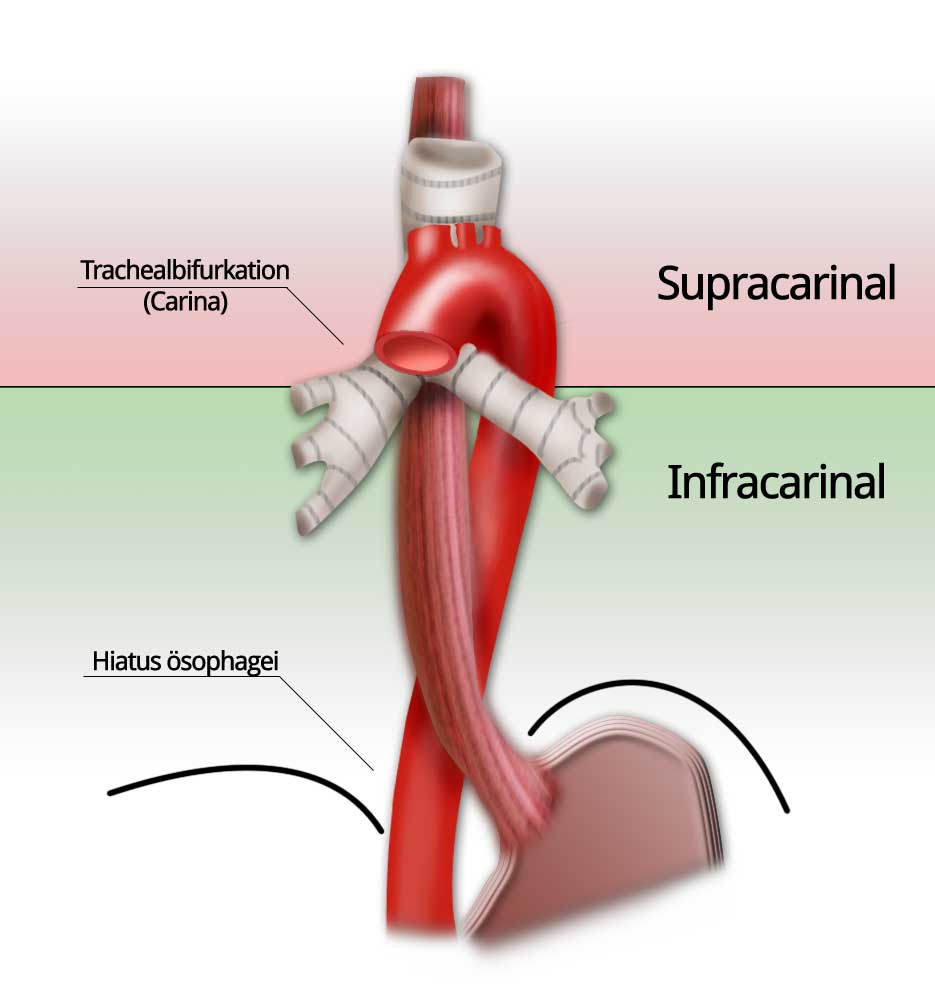
Auf Grund der engen Nachbarschaft zum Tracheobronchialsystem erfolgt die Lokalisationseinteilung der Plattenepithelkarzinome relativ zur Bifurkation der Trachea, der Carina. Diese stellt eine relativ einheitliche anatomische Landmarke dar und ist somit für eine sinnvolle Einteilung verwendbar. Die infracarinalen Tumoren haben mit ihrer nicht ganz so engen Lagebeziehung zum Tracheobronchialsystem einen prognostischen Vorteil und lassen sich daher eher primär resezieren. Bei den supracarinalen und zervikalen Tumoren erschwert die Nähe zur Trachea und zum linken Hauptbronchus eine radikale Operation.
Die Adenokarzinome sind im Gegensatz dazu fast ausschließlich im distalen Ösophagus lokalisiert. Sie entstehen auf dem Boden einer dysplastisch veränderten Schleimhaut, die durch fortbestehenden gastroösophagealen Reflux begünstigt wird. Dies erklärt die exklusive Entstehung im distalen Ösophagus.
Ätiologie
Hinsichtlich der Entstehung unterscheiden sich Plattenepithelkarinzome ganz wesentlich von den Adenokarzinomen. Beim Plattenepithelkarziom besteht ein Zusammenhang zwischen Nikotin- und Alkoholabusus sowie dem Verzehr nitrosaminhaltiger Lebensmittel. Eine Häufung ist auch bei Patienten mit Verätzungsstrikturen und Achalasie beschrieben worden. In bis zu 10% der Fälle finden sich bei Plattenepithelkarzinomen des Ösophagus Zweittumoren im HNO-Bereich.
Bei bis zu 90% der Patienten mit Adenokarzinom kann ein Barrett-Ösophagus nachgewiesen werden. Die Karzinogenese wird durch eine chronische Refluxösophagitis begünstigt, die zur Ausbildung einer Barrett-Metaplasie führen kann. Dabei wird das Plattenepithel des Ösopagus in Zylinderepithel umgewandelt. Weil die Speiseröhre durch das Hochwachsen intestinal veränderter Schleimhaut quasi verkürzt wird, spricht man auch von Endobrachyösophagus. Der Begriff Barrett-Ösophagus, der synonym verwendet wird, ist allerdings geläufiger. Man unterscheidet dabei weiter eine kurzsstreckige (3cm) Veränderung, die auch short-segment genannt wird von einem längerstreckigen long-segment barrett.
Es gilt die Faustregel, dass ca. 10% aller Patienten mit chronischem Reflux eine Barrett-Metaplasie entwickeln. Davon laufen wiederum 10% der Patienten Gefahr, ein invasives Barrett-CA zu entwickeln. Die Wertigkeit einer Antireflux-Operation hinsichtlich der Verhinderung dieser Entwicklung ist fraglich. Möglicherweise wird die Indikation hierzu zu spät gestellt, auf jeden Fall ist eine einmal eingetretene metaplastische Veränderung nicht mehr rückgängig zu machen.1
Inzidenz
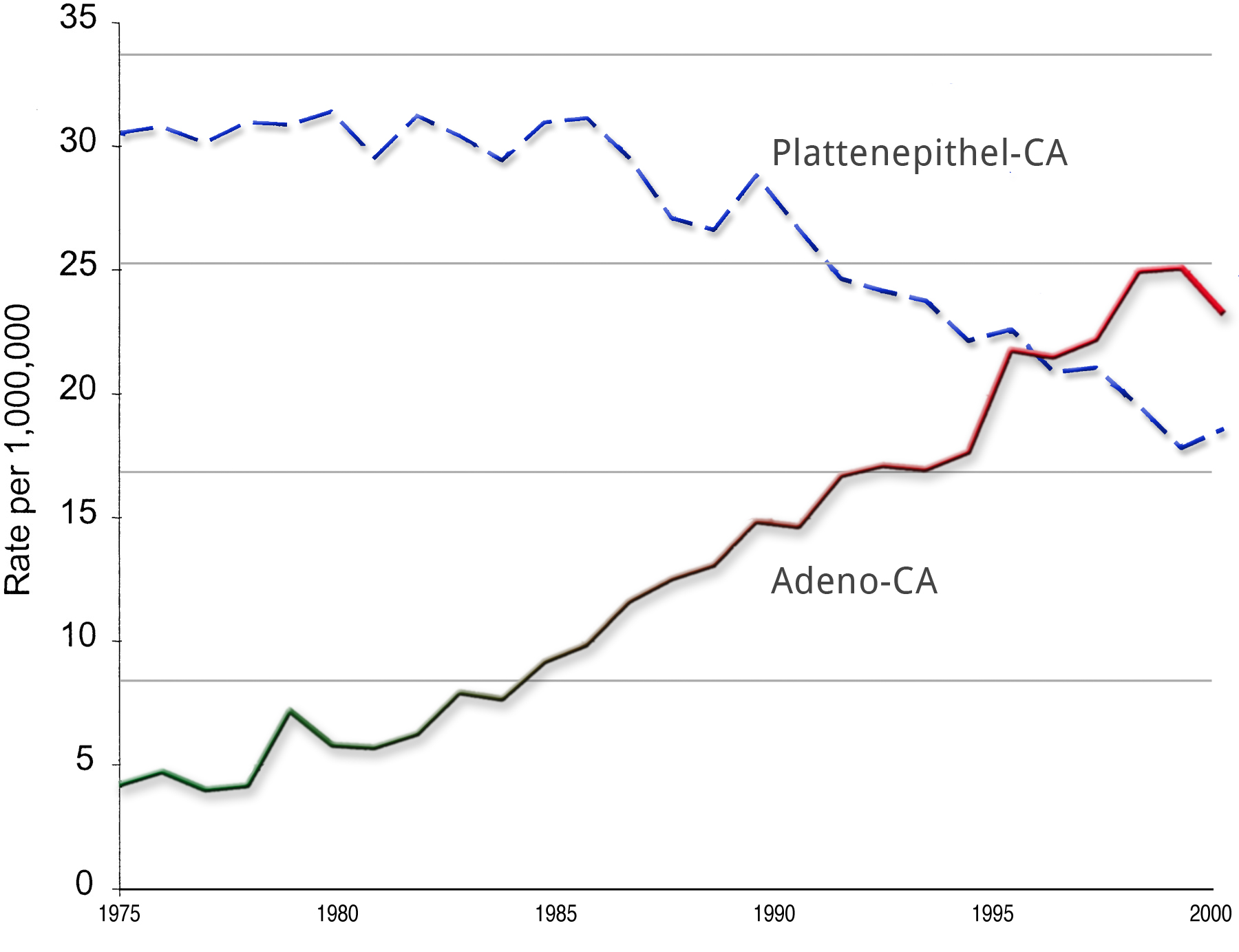
Die Inzidenz des Adenokarzinoms hat in den letzten Jahren und Jahrzehnten deutlich zugenommen, vor allem in der westlichen Welt. War vor 40 Jahren ein Adenokarzinom des Ösophagus noch eine absoulte Rarität, hat die Inzidenzrate die des Plattenepithel-CAs teilweise bereits überholt.2
Die Ursachen hierfür sind letztlich nicht vollständig geklärt. Zum einen mag es an der Veränderung der Lebens- und Ernährungsgewohnheiten liegen, zum anderen aber auch an der verbesserten Diagnostik.
Originalartikel
Wenn Sie das Thema ansteigende Inzidenz des Adeno-CAs im Ösophagus interessiert, lesen Sie doch mal folgenden Artikel bei Pubmed: The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence.
Dysphagie
Das Leitsymptom des Ösophaguskarzinoms
Symptomatik
Beim Ösophaguskarzinom gibt es unerfreulicherweise keine Frühsymptome. Die meisten Patienten berichten über Schluckstörungen, also Dysphagie. Diese tritt meistens erst auf, wenn ca. 2/3 des Lumens der Speiseröhre verlegt sind. Somit ist die Dysphagie ein Spätsymptom des Ösophaguskarzinoms.
Da es meist das einzige Zeichen ist, spricht man auch vom Leitsymptom Dysphagie. Natürlich ist das ein unspezifisches Zeichen und die Liste der möglichen Differentialdiagnosen entsprechend lang. Dennoch muss eine Dysphagie immer im Hinblick auf ein möglicherweise vorliegendes Malignom abgeklärt werden.
Differentialdiagnosen Dysphagie
- Achalasie
- Zenker-Divertikel
- Peptische Stenose
- GERD
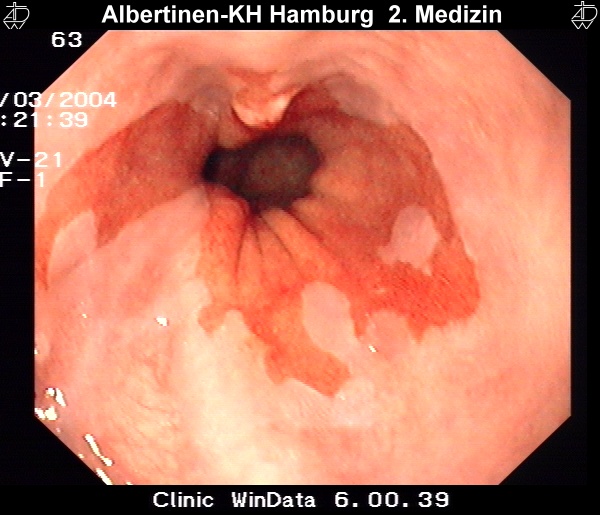
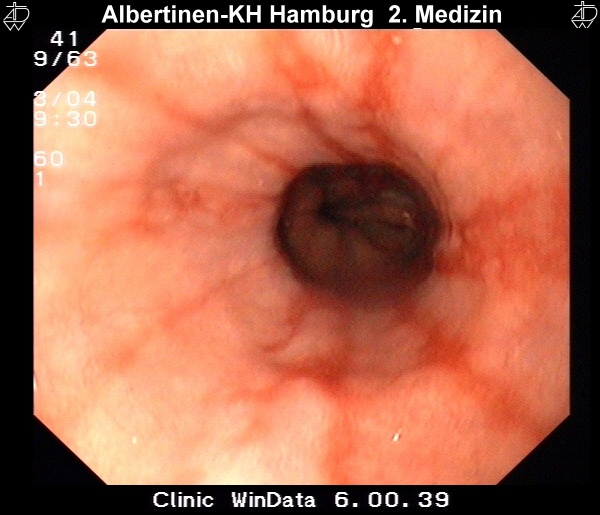
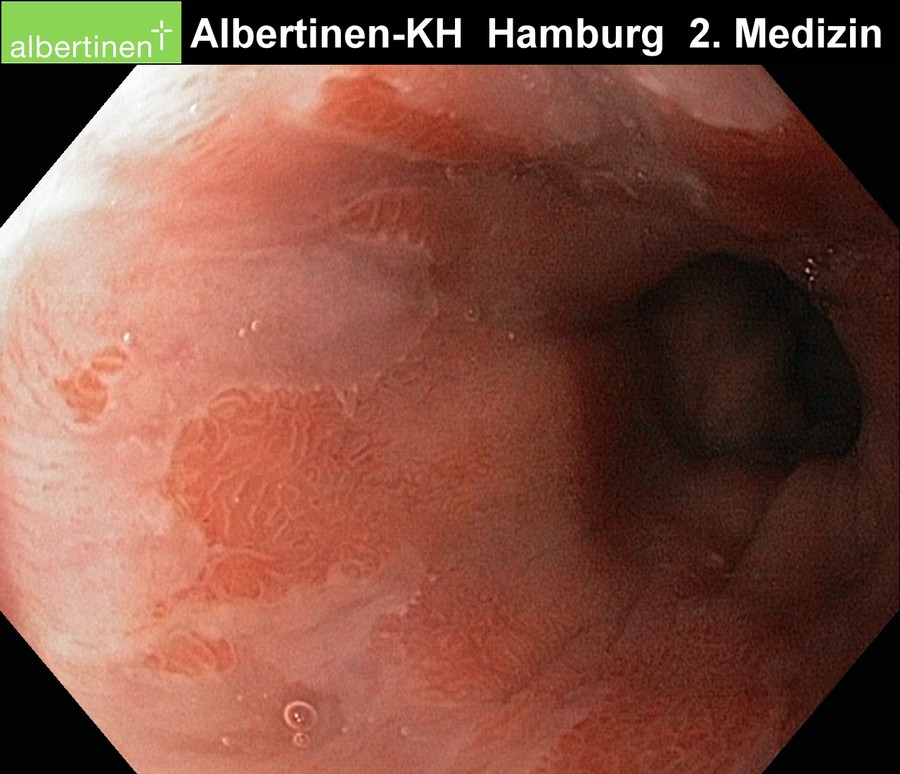
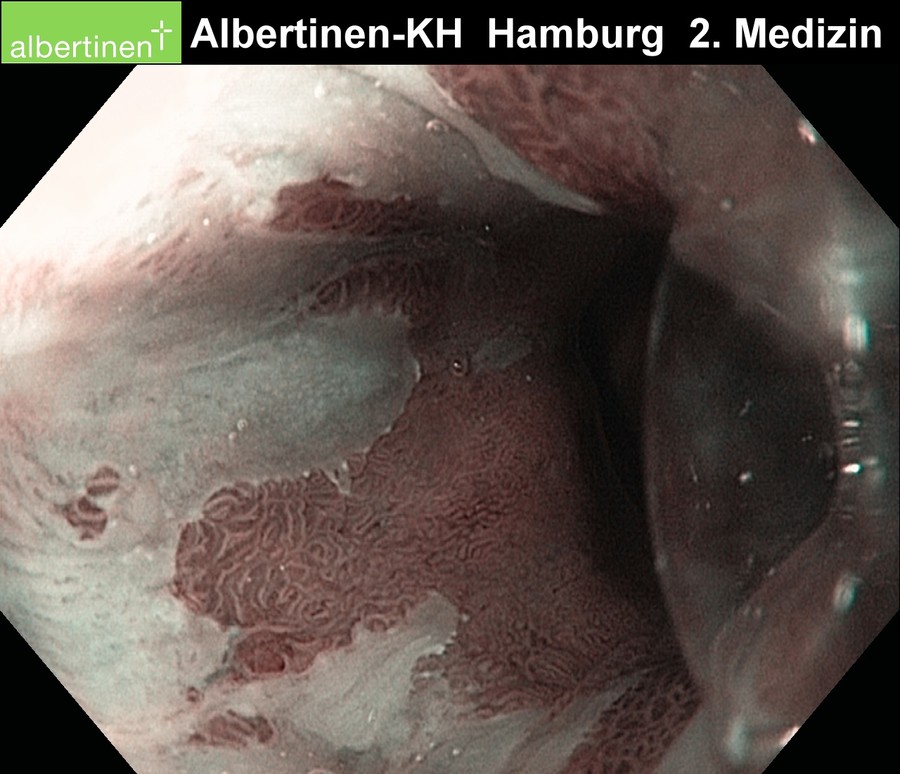
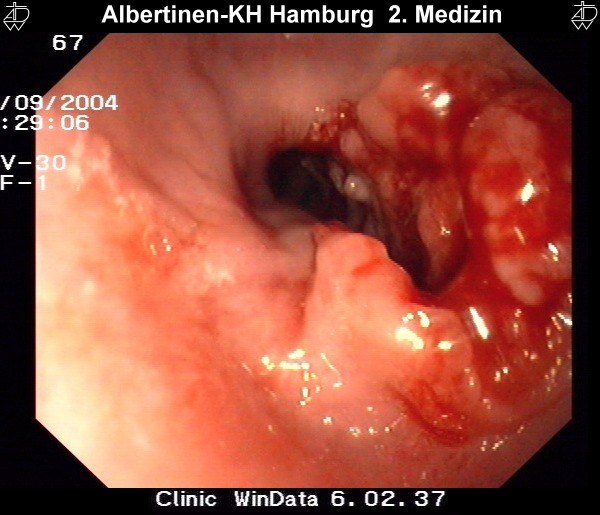
Endoskopie-Beispielbilder
mit freundlicher Genehmigung Albertinen-Krankenhaus Hamburg
Andere Symptome können z.B. Gewichtsverlust, Globusgefühl, Regurgitation oder retrosternale Schmerzen sein. Ein tastbarer Tumor oder Lymphknotenbefunde sprechen ebenso wie eine eventuell aufgetretene Heiserkeit für einen fortgeschrittenen Befund.
Vor dem Hintergrund, dass es keine sicheren Frühsymptome gibt und Ösophaguskarzinome auf Grund der stark ausgebildeten lymphatischen Drainage des Ösophagus, die unmittelbar unter der Mukosa beginnt, frühzeitig lymphatisch metastasieren, ist es nachvollziehbar, dass ein hoher Anteil der Patienten bei Erstdiagnose bereits Lymphknotenmetastasen aufweist.
Die unspezifischen Beschwerden der Patienten leiten oft in die falsche Richtung, so dass die Diagnose Ösophaguskarzinom nicht selten ein Zufallsbefund ist. Oftmals werden Adenokarzinome auch im Rahmen von Überwachungsprogrammen bei bekanntem Endobrachyösophagus bei regelmäßig wiederholten Biopsien diagnostiziert. Entsprechend der Pathogenese gibt es Hinweise, dass ein solches Surveillance-Programm nicht nur für Patienten mit bekanntem Barrett-Ösophagus sinnvoll ist, sondern auch für Patienten mit langjährig bestehender Achalasie, Verätzungsstrikturen oder Plattenepithelkarzinomen im HNO-Bereich.
Risikoanalyse
Entsprechend der Ätiologie des Ösophaguskarzinoms leiden Patienten mit einem Ösophaguskarzinom in der Regel an zahlreichen Nebenerkrankungen. Beim Plattenepithelkarzinom steht dabei in erster Linie der langjährige Nikotin- und Alkoholabusus im Vordergrund. Die Leberfunktion und vor allem der möglicherweise fortgesetzte Alkoholkonsum sind besonders wichtige Faktoren, die das Risiko eines operativen Eingriffs beeinflussen können.
Ein postoperativ auftretendes Alkoholentzugsdelir erhöht die Letalität eines Eingriffs um ca. 50 %!
Auch eine manifeste Leberzirrhose verschlechtert das Outcome der Patienten wesentlich. Sie ist unter Umständen präoperativ schwer zu objektivieren, nötigenfalls sollte die Klassifizierung unter Verwendung aller zur Verfügung stehenden Mitteln erzwungen werden, im Zweifelsfall auch mittels Leberbiopsie. Patienten mit einem Plattenepithelkarzinom sind nicht selten unter- bzw. fehlernährt. Diese Malnutrition gilt es im Vorfeld zu erkennen und zu behandeln bzw. bei der Wahl der Therapiestrategie mit zu berücksichtigen. Die obstruktive Lungenerkrankung, die oft mit einem Plattenepithelkarzinom einhergeht, lässt sich leicht mit einer Lungenfunktionsprüfung objektivieren. Dies sollte unbedingt vor einer möglichen Thorakotomie erfolgen.
Patienten mit einem Adenokarzinom sind in der Regel eher übergewichtig und leiden an einer KHK. Hier sind die kardiovaskulären Risikofaktoren vorrangig zu überprüfen.
Auch die Compliance der Patienten geht in die Risikoeinschätzung mit ein. Zur besseren Vergleichbarkeit haben sich verschiedene Scoring-Systeme herausgebildet, um der Therapieentscheidung ein möglichst objektives Fundament zu geben.3
| Plattenepithelkarzinom | Adenokarzinom |
|---|---|
| Alkoholabusus | KHK |
| Nikotinabusus | Übergewicht |
| COPD | GERD |
| Leberfunktionsstörung | |
| Malnutrition |
Vereinfachtes Risiko-Score-System4
(nach Bartels et al 1998)
| Parameter | Punktwert Score präoperativ | Wichtungsfaktor | Minimum Score | Maximum Score |
|---|---|---|---|---|
| Allgemeinzustand | 1-2-3 | 4 | 4 | 12 |
| Kardiale Funktion | 1-2-3 | 3 | 3 | 9 |
| Leberfunktion | 1-2-3 | 2 | 2 | 6 |
| Lungenfunktion | 1-2-3 | 2 | 2 | 6 |
| Summe | 11 | 33 |
1= normal 2=leichte Einschränkung 3=schwere Einschränkung
Ab einem Gesamtscore von 21 ist das Risiko deutlich erhöht, die OP-Indikation sollte sehr streng gestellt werden.
Diagnose & Staging
Endoskopie
Diagnostikmethode der ersten Wahl.
- Biopsie
- Abstand zur Frontzahnreihe
- Bezug zum gastro-ösophagealem Übergang
Röntgen-Kontrastmittel
Auch in der KM-Darstellung des Ösophagus lassen sich typische Veränderungen sehen. Eine Aussparung des Kontrastmittels oder eine Stenose sprechen dabei für ein lokal fortgeschrittenes Geschehen.
Endosonografie
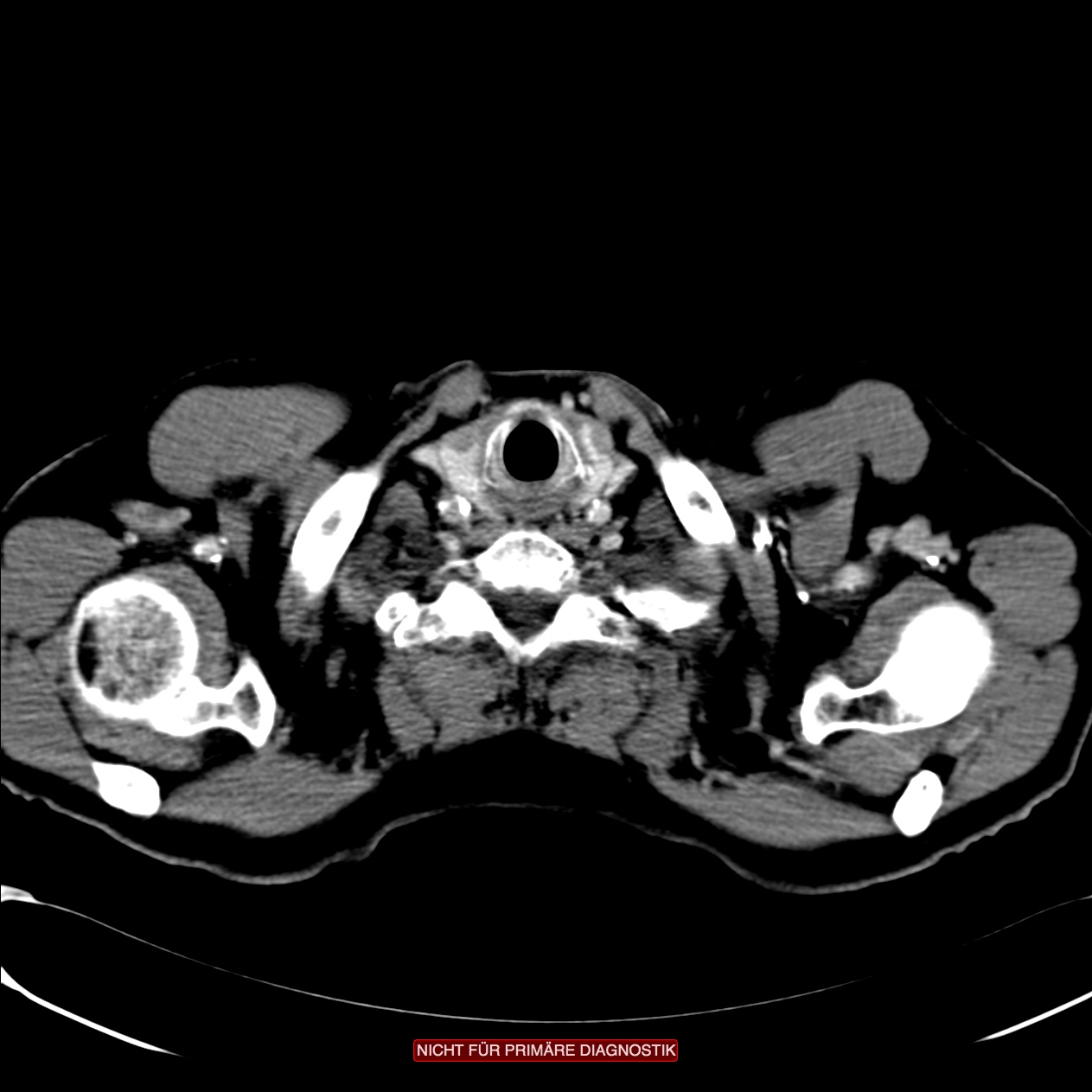
Zum lokalen Staging und zur Abschätzung der Eindringtiefe in die Wand des Ösophagus dient die Endosonografie. Auch möglicherweise befallene Lymphknoten lassen sich darstellen.
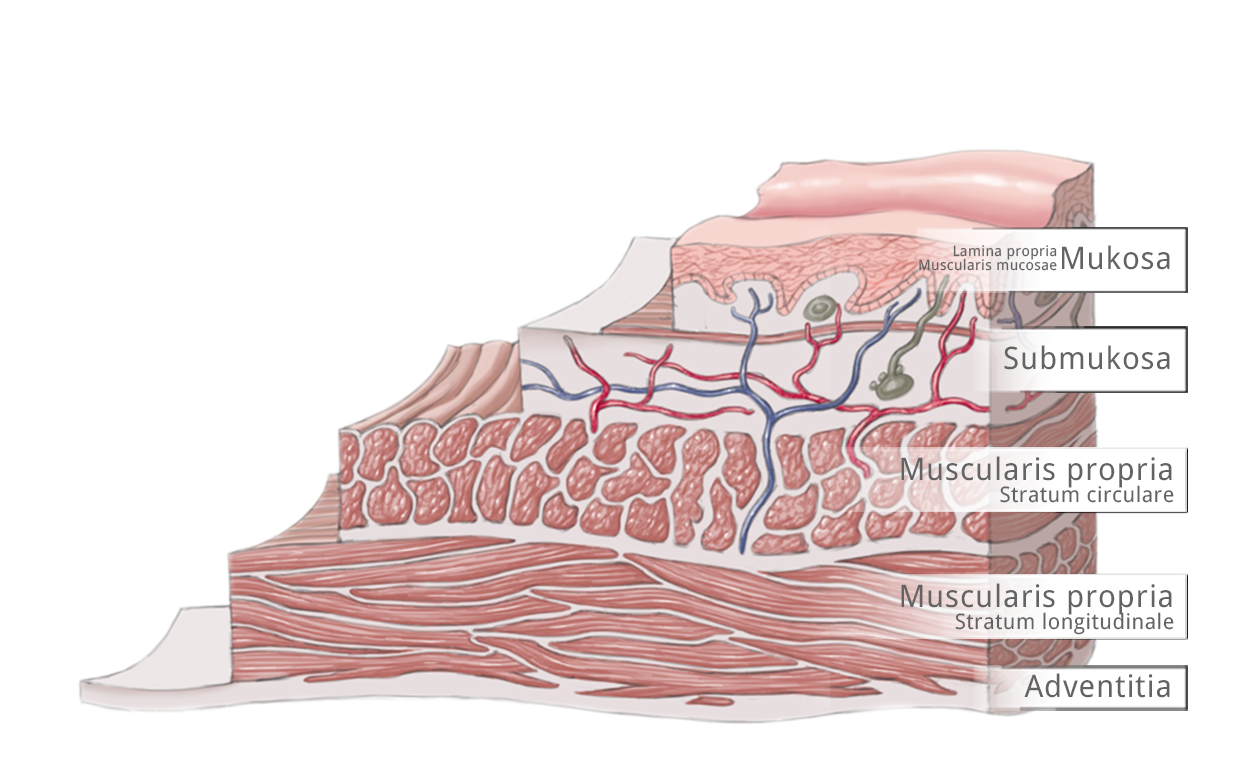
Der Wandaufbau des Ösophagus gliedert sich in Mukosa mit Lamina propria und Lamina muscularis mucosae, Tela submukosa, Tunika muscularis mit Stratum circulare und Stratum longitudinale und die Tunica adventitia. Angrenzend daran liegen die Nachbarstrukturen des Ösophagus.
Nach der TNM-Klassifikation werden T1a Tumoren durch Infiltriatin der Mukosa bis in die Lamina muscularis mucosae definiert. Die T1b Tumoren infiltrieren in die Submukosa, wobei drei unterschiedliche Eindringtiefen unterschieden werden. T2-Tumoren beziehen sich auf die Muscularis, T3 erreichen die Adventitia und T4-Tumoren infiltrieren Nachbarorgane.
Staging
Die Einteilung der Ösophaguskarzinome erfolgt nach den Regeln der UICC. Hinsichtlich der Wahrscheinlichkeit von Lymphknotenmetastasen unterscheiden sich Plattenepithel- und Adenokarzinome.
Während bei Ersteren bereits sehr früh und ab einer geringen Eindringtiefe Lymphknotenmetastasen auftreten, ist die Rate bei den Adenokarzinomen geringer. Eine mögliche Eklärung dafür ist die Obstruktion der Lymphwege durch chronische Entzündungen bei langjährig bestehender Refluxösophagitis.
TNM 7 2009 – deutsche Auflage 2010
Optionale Untersuchungen
-
- Bronchoskopie zum Ausschluss einer ösophagobronchialen Fistel
- Staging-Laparoskopie zum Ausschluss einer Peritonealkarzinose
- Untersuchungen zur Risikostratifizierung
- Tumormarker nur im Verlauf (Plattenepithelkarzinom: SCC, Adenokarzinom: CEA)
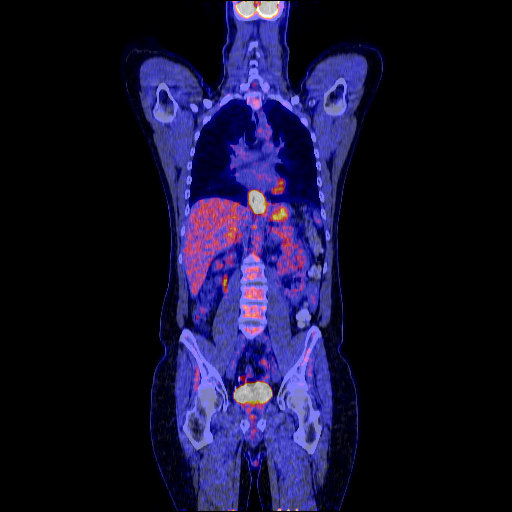
FDG-PET
Eine Positronenemmisonstomografie mit Fluorodeoxyglukose bietet vor allem in Kombination mit einem CT zusätzliche Genauigkeit bei der Detektion von befallenen Lymphknoten oder Fernmetastasen.5
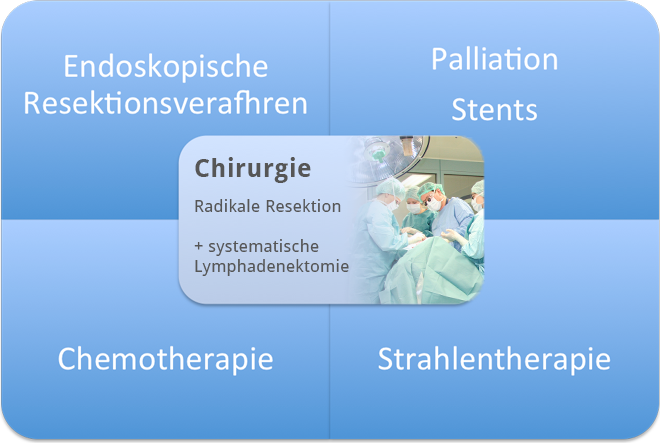
Multimodale Therapie
Der prognostisch entscheidende Schritt in der Behandlung des Ösophaguskarzinoms ist die radikale chirurgische Resektion zusammen mit der systematischen Lymphknotenentfernung. Das erkannte Theodor Billroth bereits 1890, der konstatierte: "Die Therapie des Ösophaguskarzinoms gehört in die Hand des Chirurgen"
Nichts desto trotz ist die Therapie heute in multimodale Konzepte eingebettet, in der Strahlen- und Chemotherapie ebenso eine wichtige Rolle spielen wie endoskopische Verfahren.
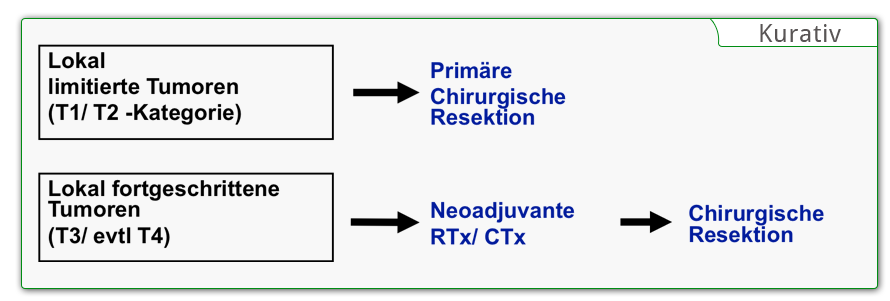
Lokal resektabel
"Technische Operatibilität"
Keine Fernmetastasen
Prinzipielle Voraussetzungen
Jeder operativen Maßnahme beim Ösophaguskarzinom müssen zwei prinzipielle Grundüberlegungen vorausgehen: Ist der Tumor resektabel, d.h. technisch vollständig resezierbar und ist der Patient vom Allgemeinzustand in der Lage, eine Operation zu überstehen. Man könnte neben der technischen Operabilität auch von der funktionellen Operabilität sprechen. Da insbesondere Patienten mit einem Plattenepithelkarzinom häufig an schweren Nebenerkrankungen leiden, ist die Risikoabschätzung sehr wichtig.
Dazu dienen Risiko-Scoresysteme, die die kardiopulmonale Situation der Patienten aber auch Faktoren wie die Compliance berücksichtigen.
Patient operabel
"Funktionelle Operabilität"
Risikoanalyse
Stadienadaptierte Therapie
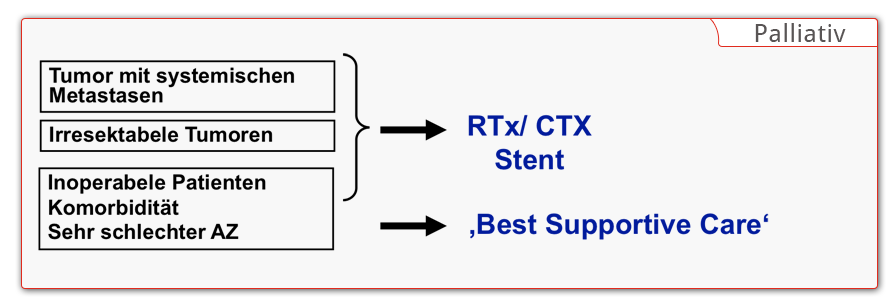
Die vollständige Entfernung des Tumors ist das Ziel jedes chirurgischen Eingriffs beim Ösophaguskarzinom. Erscheint eine R0-Resektion bei lokal fortgeschrittenen Tumoren primär nicht erreichbar, wird eine neoadjuvante Chemotherapie bzw. Radiochemotherapie vorgeschaltet. Je nach Ansprechen kann eventuell eine sekundäre Resektabilität erreicht werden. Dazu wird im Rahmen des Restagings die Response des Tumors auf die Neoadjuvanz geklärt. Sollte der Patient aus funktionell inoperabel sein wird eine definitive Radiotherapie bzw. Radiochemotherapie durchgeführt. In Situationen mit irresketablen Tumoren oder bei Vorliegen von Fernmetastasen bleibt die palliative Therapie mit “best supportive care.”
Lokal limitierte Resektionsverfahren bleiben den sehr frühen Stadien des Adeno-Ca vorbehalten. Bereits bei Infiltration der Submukosa steigt das Risiko von Lymphknotenmetastasen deutlich an, so dass bei einer endoskopischen Mukosaresektion keine ausreichende Radikalität gegeben ist. Bei Plattenepithelkarzinomen scheidet eine lokal limitierte Therapie ebenfalls aus, dass es häufig zu einer longitudinalen submukösen Lymphangiomatosis carcinomatosa kommt.
Chirurgische Therapie
Das Ziel der chirurgischen Behandlung des Ösophaguskarzinoms ist die subtotale Resektion der Speiseröhre und Entfernung der regionalen Lymphknoten. Eine Ausnahme bilden frühe Stadien von Adenokarzinomen, bei denen eine limitierte Resektion des distalen Ösophagus und des gastroösophagealen Übergangs gerechtfertigt sein kann. Bei in-situ-Karzinomen ist die endoskopische Mukosaresektion eine Option, wenn man berücksichtigt, dass bereits ab eine geringen submukösen Eindringtiefe Lymphknotenmetastasen auftreten können und eine ausreichende Radikalität dann nicht mehr gegeben ist.
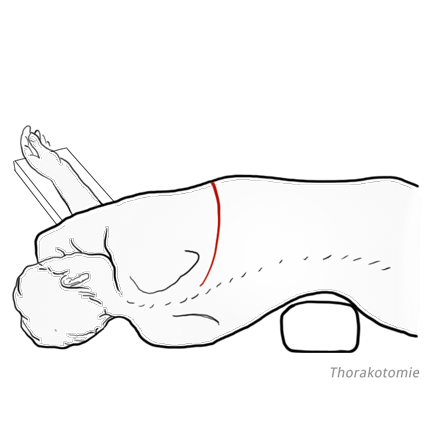
Der Resektion folgt dann die Rekonstruktion der Nahrungspassage. Hierbei stehen verschiedene Techniken zur Verfügung, es kann beispielsweise ein Magenschlauch als Ösophagusersatz verwendet werden oder ein Koloninterponat zum Einsatz kommen. Die Operation eines Ösophaguskarzinoms ist also ein “Zwei-Höhlen-Eingriff”, bei dem thorakal reseziert und abdominell rekonstruiert wird. Insbesondere die Thorakotomie birgt jedoch ein nicht unerhebliches Morbiditätsrisiko für cardiopulmonal vorbelastete Patienten. Um das Risiko für den Patienten zu verringern, ist es daher möglich, die Resektion des Ösophagus ohne Thorakotomie vorzunehmen. Dabei wird der Ösophagus stumpf mit den Fingern aus dem Mediastinum ausgehülst.
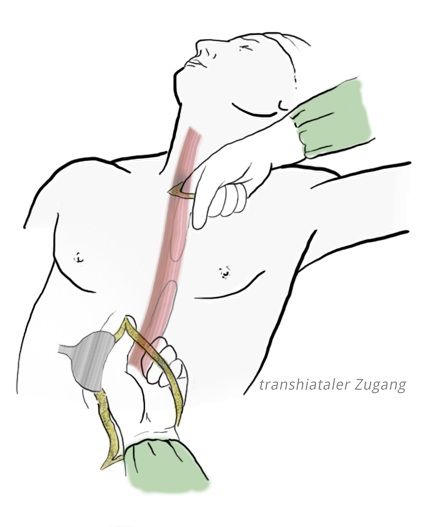
Transhiataler Zugang
Dabei wird von abdominell über einen transhiatalen Zugang präpariert und über eine zusätzliche zervikale Inzision die Präparation stumpf komplettiert. Dies hilft, insbesondere pulmonale Komplikationen postoperativ zu vermeiden. Allerdings ist die begleitende Lymphadenektomie nicht in gleichem Ausmaß möglich, so dass hier Kompromisse eingegangen werden müssen. Während das Ausmaß der abdominellen Lymphadenektomie bei beiden Verfahren identisch ist, werden beim transhiatalen Zugang weniger thorakale Lymphknoten mitentfernt. Dies ist möglicherweise auch der Grund für ein schlechteres Overall-survival bei Patienten, die eine transhiatale Resektion erhalten haben.6,7
Sicherheitschirurgie
Bei Patienten, die präoperativ eine Radio- oder Chemotherapie erhalten haben, kann unter dem Aspekt der Sicherheitschirurgie auch ein zweizeitiges Vorgehen gewählt werden. Im ersten Schritt erfolgt die rechst-thorakale Ösophagusresektion mit mediastinaler Lymphadenektomie, die Rekonstruktion wird frühestens eine Woche später durchgeführt unter der Annahme, dass dann das hintere Mediastinum bereits hinreichend verklebt ist, so dass selbst beim Auftreten einer Anastomoseninsuffizienz nicht mit einer für den Patienten sehr bedrohlichen Mediastinitis zu rechnen ist. Die Ernährung wird in dieser Zeit über eine vorübergehend angelegt PEG-Sonde durchgeführt, also eine durch die Bauchwand führende Ernährungssonde, die im Magen zu liegen kommt.
Rekonstruktion
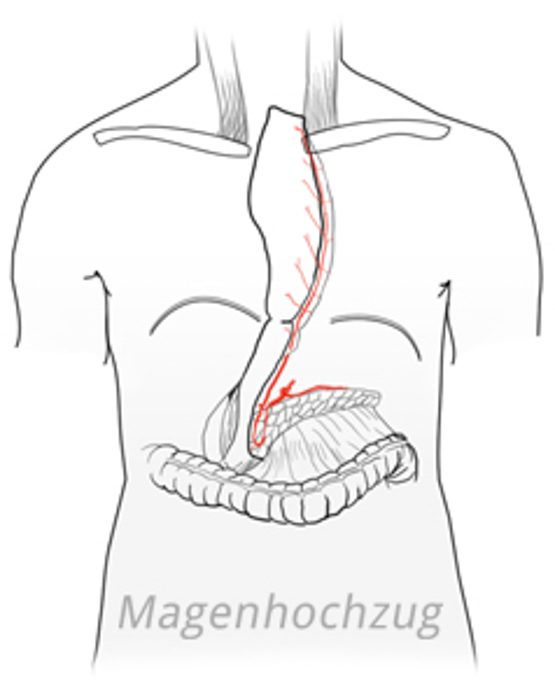
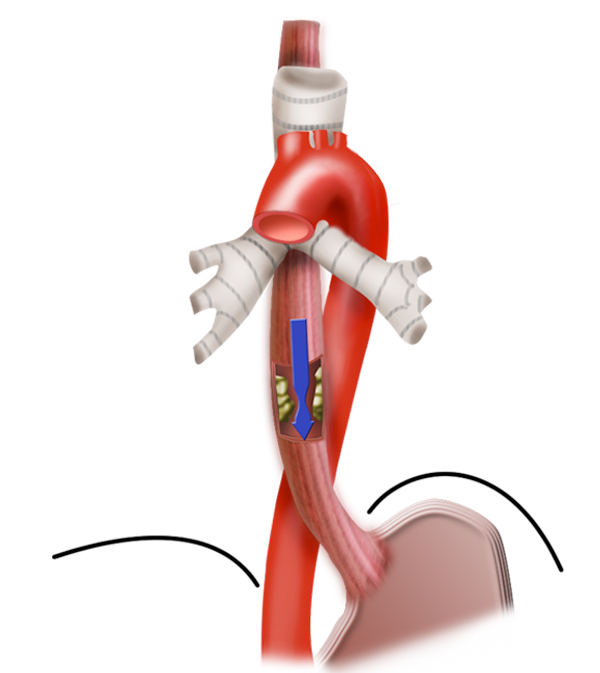
Um den entstandenen Defekt nach der Ösophagusresektion zu rekonstruieren, stehen verschiedene Verfahren zur Auswahl. Beim Magenhochzug wird mit einem Klammernahtgerät ein schlanker Magenschlauch gebildet. Die große Kurvatur bleibt dabei erhalten, der Magenschlauch wird über die A. gastroepiploica dextra mit Blut versorgt.
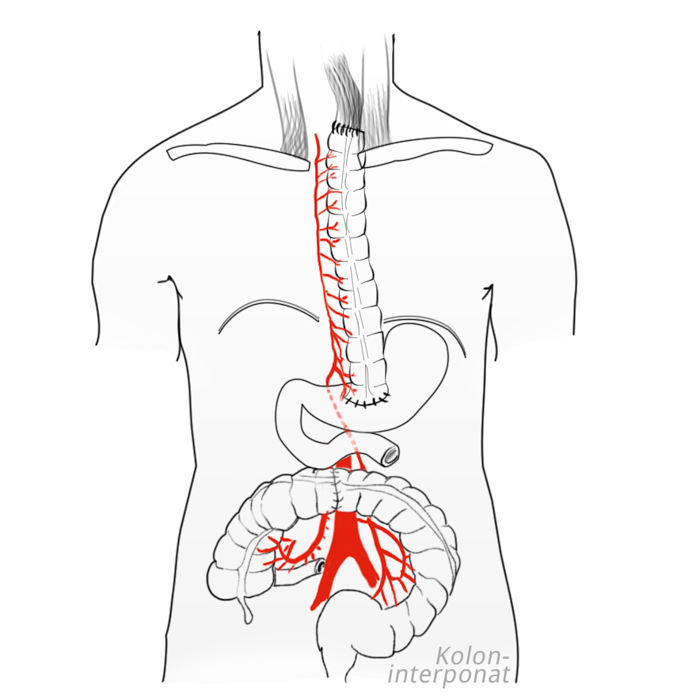
Um die Möglichkeit zu haben, alternativ das Kolon als Interponat zu nutzen, sollte vor einer Ösophagusresektion eine Koloskopie durchgeführt werden, um Pathologien in diesem Bereich auszuschließen. Das Kolon transversum ist dabei ebenso wie das rechte Hemikolon als Interponat geeignet.
Die Rekonstruktion der Nahrungspassage kann im originären Bett der Speiseröhre erfolgen, also mediastinal. Dies bietet die bessere postoperative Schluckfunktion. Alternativ kann das Interponat extraanatomoisch retrosternal oder sogar antesternal durchgezogen werden, dies macht vor allem dann Sinn, wenn eine Nachbestrahlung geplant ist. Die Anastomose kann mittels Handnaht oder maschinell mit Stapler-Klammernahtgeräten durchgeführt werden. Die Anastomose kann dabei zervikal oder intrathorakal zum Liegen kommen, was sich als internationaler Standard durchgesetzt hat.
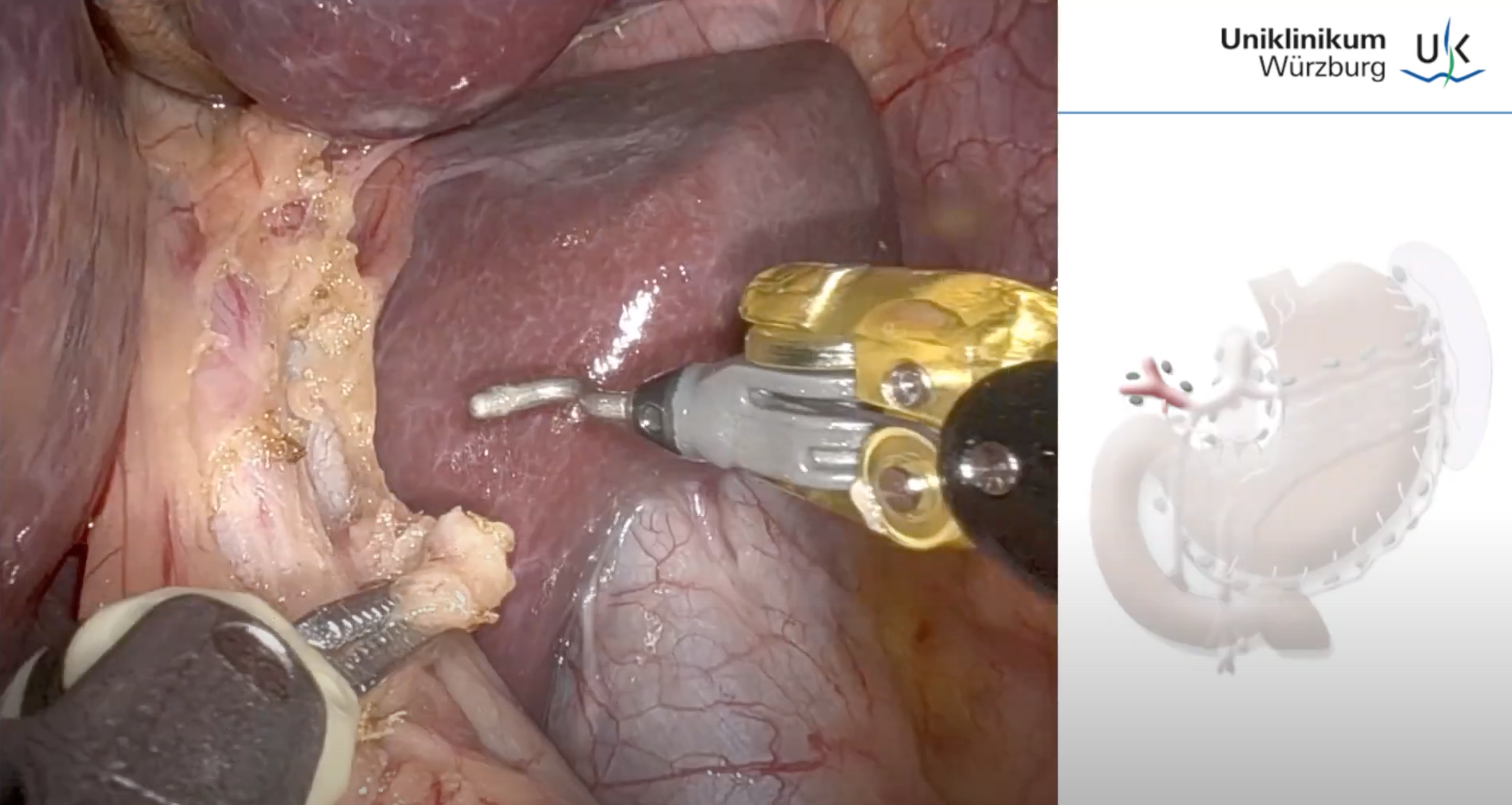
OP-Video: Roboterassistierte minimalinvasive Ösophagusresektion (RAMIE)
Von minimalinvasiven Operationszugänge profitieren Patienten in großem Maße, in dem das Zugangstrauma minimiert wird. Dies führt zum Einen zu einer schnelleren Erholung nach dem Eingriff sowie zu einer deutlichen Reduktion der Morbidität und Mortalität. In der Chirurgie des Ösophaguskarzinoms hat sich mittlerweile die roboterassistierte thorakoabdominale minimalinvasive Ösophagusresektion als Standard etabliert.
In diesem Videobeitrag sehen Sie eine solche RAMIE-Prozedur präsentiert von Prof. Dr. F. Seyfried.
Der Videolink führt zu YouTube.com
Literatur
- The risk of esophageal adenocarcinoma after antireflux surgery.
Gastroenterology. 2010 Apr;138(4):1297-301. doi: 10.1053/j.gastro.2010.01.004. Epub 2010 Jan 18.Lagergren J, Ye W, Lagergren P, Lu Y. - The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence.J Natl Cancer Inst. 2005 Jan 19;97(2):142-6.Pohl H, Welch HG.
- Risk analysis in esophageal surgery.Recent Results Cancer Res. 2000;155:89-96.Bartels H, Stein HJ, Siewert JR.
- Preoperative risk analysis and postoperative mortality of oesophagectomy for resectable oesophageal cancer. Br J Surg. 1998 Jun;85(6):840-4.Bartels H, Stein HJ, Siewert JR.
- The incremental effect of positron emission tomography on diagnostic accuracy in the initial staging of esophageal carcinoma.Cancer. 2005 Jan 1;103(1):148-56.Kato H, Miyazaki T, Nakajima M, Takita J, Kimura H, Faried A, Sohda M, Fukai Y, Masuda N, Fukuchi M, Manda R, Ojima H, Tsukada K, Kuwano H, Oriuchi N, Endo K.
- Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus.N Engl J Med. 2002 Nov 21;347(21):1662-9.Hulscher JB1, van Sandick JW, de Boer AG, Wijnhoven BP, Tijssen JG, Fockens P, Stalmeier PF, ten Kate FJ, van Dekken H, Obertop H, Tilanus HW, van Lanschot JJ.
- Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of a randomized clinical trial.Ann Surg. 2007 Dec;246(6):992-1000; discussion 1000-1.Omloo JM1, Lagarde SM, Hulscher JB, Reitsma JB, Fockens P, van Dekken H, Ten Kate FJ, Obertop H, Tilanus HW, van Lanschot JJ.


 Wunde, Wundheilung
Wunde, Wundheilung Infektion
Infektion Akutes Abdomen
Akutes Abdomen Abdominaltrauma
Abdominaltrauma Ileus
Ileus Hernien
Hernien Struma benigna
Struma benigna Schilddrüsen-CA
Schilddrüsen-CA Nebenschilddrüsen
Nebenschilddrüsen Hypderthyreose
Hypderthyreose Nebenniere
Nebenniere Achalasie
Achalasie Ösophagus-CA
Ösophagus-CA Ösophagusdivertikel
Ösophagusdivertikel Ösophagusperforation
Ösophagusperforation Verätzung
Verätzung Magen-CA
Magen-CA Ulkuskrankheit
Ulkuskrankheit GERD
GERD Adipositas
Adipositas CED
CED Divertikulitis
Divertikulitis Kolon-CA
Kolon-CA Proktologie
Proktologie Rektum-CA
Rektum-CA Aantomie
Aantomie Ikterus
Ikterus Cholezystolithiais
Cholezystolithiais Benigne Leberläsionen
Benigne Leberläsionen Maligne Leberläsionen
Maligne Leberläsionen Pankreatitis
Pankreatitis Pankreaskarzinom
Pankreaskarzinom