Aortendissektion
Zusammen mit dem Intramuralen Hämatom (IMH) und dem Penetrierenden aortalen Ulcus (PAU) bildet die Aortendissektionden Formenkreis des „Akuten Aortensyndroms“. Bei der Dissektion handelt es sich um die häufigste aortale Notfallsituation, ca. 0,1 – 0,5 % aller Patienten, die sich in einer Notaufnahme aufgrund thorakaler Schmerzen vorstellen, haben eine Aortendissektion (Von Kodolitsch Y et al (2000) Clinical predicition of acute aortic dissection. Arch Intern Med 160(19): 2977 – 2982).
Als Dissektion bezeichnet man einen inneren Einriss der Aortenwand, den sogenannten „intimomedialen Einriss“ mit Aufspaltung der Tunica media und Ausbildung eines falschen Lumens, welches sich, bedingt durch den pulsatilen Blutstrom, nach antegrad oder retrograd ausbreiten kann. Der primäre Einriss wird als „entry“, mögliche Wiederanschlüsse des falschen Lumens an das Originallumen des Gefäßes als „reentry/ies“ bezeichnet.
Zu den Ursachen einer Aortendissektion zählen degenerative Gefäßprozesse im Sinne einer Arteriosklerose, Bindegewebs- oder Texturstörungen (z.B. Marfan-Syndrom, Ehlers-Danlos-Syndrom, Loeys-Dietz-Syndrom), Erdheim-Gsell-Medianekrose, Dezelerationstraumen, Aortitiden und iatrogene Verletzungen, z.B. im Rahmen von Katheterinterventionen. Weiterhin besteht eine Assoziation mit arterieller Hypertonie, Nikotinabusus, Fettstoffwechselstörungen, Kokain- und Amphetaminabusus, einer bikuspiden Aortenklappe (ca. 18fach erhöhtes Risiko), Aortenisthmusstenosen und Schwangerschaft (vor allem 3. Trimenon).
Einteilung
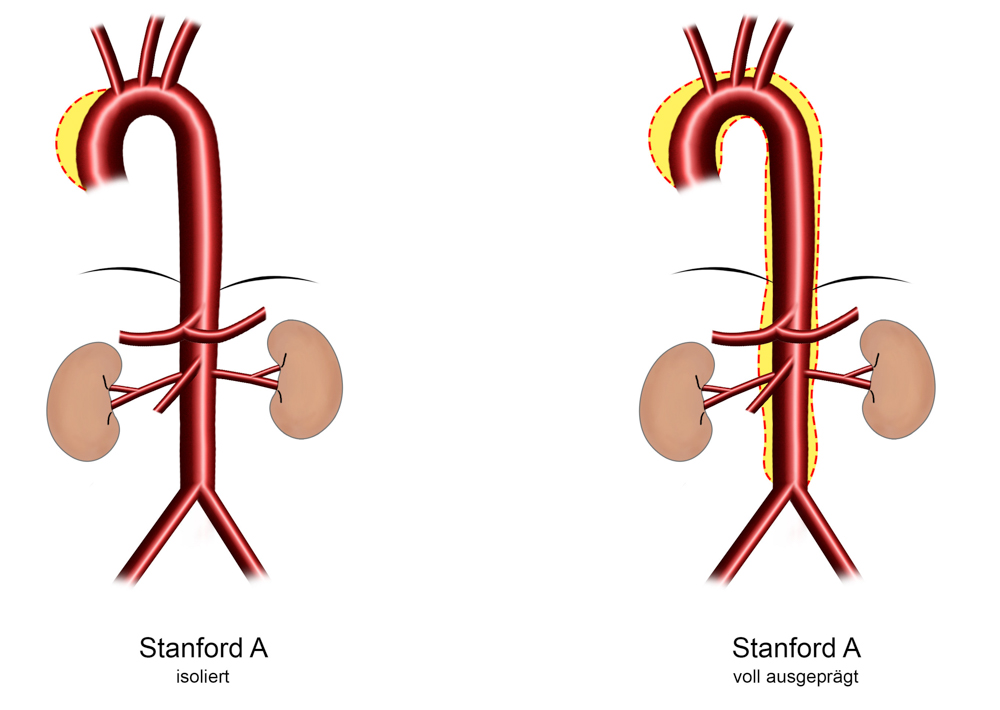
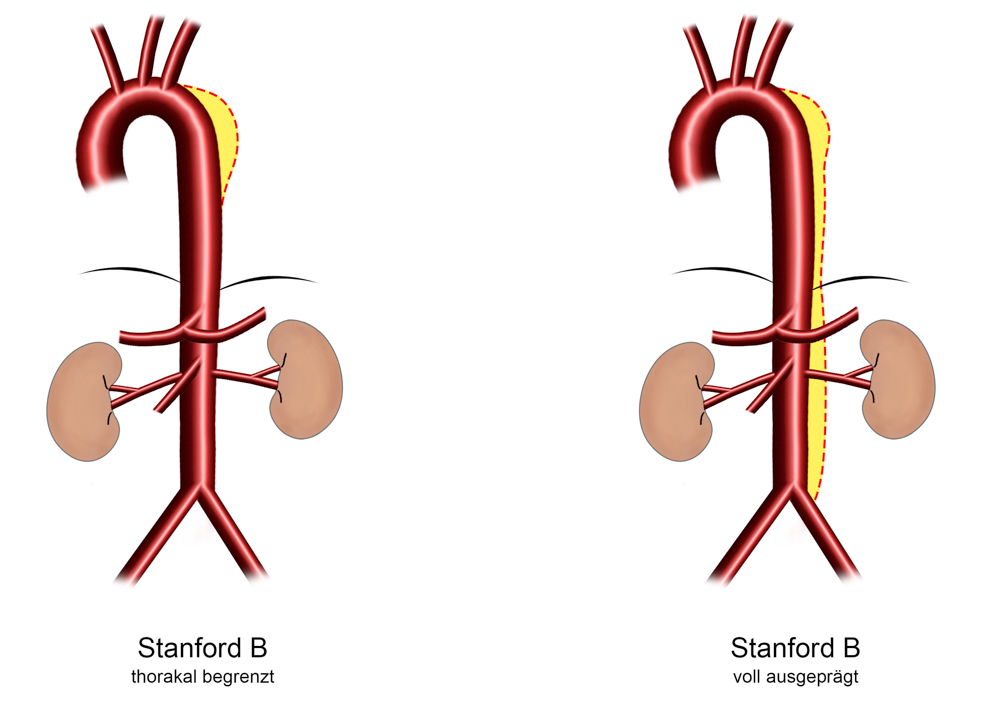
In Abhängigkeit der Lokalisation des primären Einrisses und des Ausbreitungsmusters der Dissektion erfolgen die im klinischen Alltag gebräuchlisten Einteilungen der Aortendissektion nach DeBakey in Typ I-III (DeBakey ME, Henley WS, Cooley DA, Morris GC, Crawford ES, Beall AC Jr. Surgical management of dissecting aneurysms oft he aorta. J thorac Cardiovasc Surg 1965; 49:130-49)und Stanfordin Typ A und Typ B (Daily PO, Trublood HW, Stinson EN, Wuerflein RD, Shumway NE. Management of acute aortic dissections. Ann Thorac Surg 1970; 10: 237-47):
DeBakey I + II = Stanford A– Das Entry liegt in der Aorta ascendens, mit unterschiedlicher, weiterer Ausdehnung der Dissektion nach distal (DeBakey I) oder Begrenzung der Dissektion auf die Aorta ascendens (DeBakey II), ca. 65% aller Dissektionen, Altersgipfel eher bei Patienten < 60 Jahre
DeBakey III = Stanford B– Das Entry liegt distal der linken Arteria subclavia in der Aorta descendens mit unterschiedlicher distaler Dissektionsausbreitung, ca. 35% aller Dissektionen, Altersgipfel eher bei Patienten > 60 Jahre
Der Einfachheit halber wird im weiteren Verlauf nur die Stanford-Klassifikation verwendet.
Diagnostik
Klinisch besteht häufig ein perakutes Schmerzereignis, die Betroffenen geben oftmals einen reißenden Vernichtungsschmerz an, der bei der A-Dissektion eher ventral/thorakal/sternal, bei der B-Dissektion eher im Bereich der thorakalen Brustwirbelsäule/interscapular angegeben werden kann. Je nach Ursprung und Ausbreitungsmuster der Dissektion variiert die klinische Symptomatik stark. So kann eine sich antegrad ausbreitende Stanford A-Dissektion mit Fortleitung in die Carotiden zu einem Apoplex mit entsprechenden neurologischen Ausfallserscheinungen führen. Eine Dissektion in die Reno-Viszeralarterien kann eine renale oder mesenteriale Minderperfusion und Ischämie verursachen. Auch eine Querschnittssymptomatik durch Kompromittierung der Rückenmarksperfusion ist möglich.
Nach der Erhebung des Pulsstatus als obligater Basisdiagnostik kommt der notfallmäßig durchgeführten CT-Angiographie von supraaortalen Gefäßen, thorakaler und abdomineller Aorta die diagnostisch entscheidende Rolle zu.
Generell handelt es sich bei der A-Dissektion um eine akute lebensbedrohliche Situation, die einer sofortigen operativen Versorgung bedarf. Die Letalität beträgt unbehandelt 50% innerhalb 48h, d.h. ca 1%/h (Agnastopoulos CE, Prabhakar MJS, Kittle CF. Aortic dissections and dissecting aneurysms. Am J Cardiol 1972; 30: 263-73). Hier führt die Dissektion häufig zu einer akuten Aortenklappeninsuffizienz, Verschluss der Koronarostien und Perikardtamponade durch ein Hämatoperikard. Die Behandlung besteht zumeist in einem notfallmäßig durchgeführten Aortenbogen- und -Klappenersatz durch einen Herz-Thorax-Chirurgen. Mittlerweile werden auch endovasculäre Methoden ggf. in Kombination mit offenen Operationsschritten im Sinne von Hybridoperationen durchgeführt (z.B. thorakaler Stentgraft + Debranching der supraaortalen Gefäße).
Auf die A-Dissektion soll an dieser Stelle nicht weiter eingegangen werden. Sie ist Domäne der Thoraxchirurgie.
Therapie
Primäres Behandlungsziel bei der Therapie der B-Dissektion ist die Überführung der Dissektion von einem akuten in ein chronisches, stabiles Stadium. Geläufig ist bislang eine Einteilung in akute (bis 2 Wochen nach Indexereignis) und chronische (ab 2 Wochen nach Indexereignis) Dissektionen, wobei diese Unterscheidung zunehmend diskutiert wird. Die Literatur kennt ferner auch eine subakute Phase (2-6 Wochen nach Indexereignis) (Steuer J, Björck M, Mayer D et al (2013) Distinction between acute and chronic type B aortic dissection: Is there a sub-acute phase? Eur J Vasc Endovasc Surg 45(6): 627-631). Hintergrund ist, dass auch nach 2 Wochen prinzipiell noch vitale Komplikationen möglich sind. „Chronisch“ ist somit nicht zugleich zwingend „stabil“.
Generell wichtig für die Therapie ist die Unterscheidung einer unkomplizierten von einer komplizierten Typ-B-Dissektion:
Die Standardtherapie der akuten, unkomplizierten B-Dissektion ist primär konservativ. Maßnahmen sind die Einstellung von Blutdruck und Puls auf einer Überwachungs-/Intensivstation (RR syst. 100-120mmHg, mittlerer arterieller Druck / MAD 60-70mmHg, HF < 60/Min.), ß-Blockade, ausreichende Analgesie im Sinne eines sogenannten „best medical treatment“.
Mit Hilfe von Kontroll-CT-Angiographien (z.B. am Aufnahmetag, nach 7 Tagen, nach 6 Wochen, nach 1 Jahr) wird auf Änderungen der Dissektions- und Aortenmorphologie geachtet. Bleibt der Patient stabil und
die Dissektion kann in ein unkompliziertes, chronisches Stadium überführt werden, kann der Patient unter einem „best medical treatment“ (Blutdruckeinstellung, ASS, Statin) weiter kontrolliert werden; eine interventionelle/offen operative Therapie ist zunächst nicht indiziert.
Unter einer Komplikation einer B-Dissektion versteht man die Malperfusion von Organen, Aneurysmabildung, Ruptur, konsekutive/r Schock/Hypotension, Blutdruckentgleisungen trotz medikamentöser Therapie, persistierende Schmerzen, ein zunehmendes intramurales Hämatom (IMH), neu aufgetretene oder zunehmende Pleuraergüsse oder eine retrograde B-Dissektion. Dieses Stadium entsteht in ca. 25% aller B-Dissektionen. Bei Vorliegen eines komplikativen Stadiums kommt für die B-Dissektion eine interventionelle/offen operative Therapie in Betracht.
Primäres Therapieziel der heutzutage zumeist endovasculären Therapie ist der Verschluss des proximalen Entrys, damit das falsche Lumen thrombosiert und sich zurückbildet (sog. „Remodeling“) und nicht weiter zu einer Kompromittierung oder gar zum Verschluss des wahren Lumens führt (sog. „True lumen-Kollaps“).
Goldstandard ist dabei mittlerweile die TEVAR (Thoracic EndoVascular Aortic Repair), d.h. die (zumeist transfemorale) Einbringung eines Aortenstentgrafts nach thorakal und/oder thorako-abdominell. Im Notfall kann dabei die linke Arteria subclavia überstentet werden, ggf. ist die Anlage eines Carotis-Subclaviabypasses links erforderlich, um die Perfusion der linken oberen Extremität zu gewährleisten.
In bis zu 40% aller B-Dissektionen entwickelt sich in der chronischen Phase im Verlauf ein behandlungsbedürftiges Aneurysma der descendierenden thorakalen Aorta (DTAA) oder thorako-abdominell (TAAA) (Durham CA, Cambria RP, Wang LJ et al (2015) The natural history of medically managed acute type B aortic dissection. J Vasc Surg 61: 1192-1199), in ca. 15-20% der Fälle ein thorako-abdominelles Aneurysma (siehe Kapitel TAAA).
Aneurysmen im Bereich der renoviszeralen Arterien (sog. Segment IV der Aorta nach Ishimaru) können mittlerweile z.B. durch gefensterte / fenestrierte Stentprothesen oder Stentprothesen mit speziellen Seitenarmen / branches versorgt werden (siehe Kapitel TAAA). Zu beachten ist natürlich, dass die unterschiedlichen Gefäße auch tatsächlich alle aus dem wahren Lumen versorgt werden, eins der Hauptprobleme der aortalen Dissektion. Ferner gibt es Therapiestrategien, die Dissektionslamelle zu fenestrieren oder das falsche Lumen mit Coils/Metallspiralen, Flüssigkeiten oder speziellen vorgefertigten Stopfen/ sog. „plugs“ zu okkludieren.
Sollte eine TEVAR nicht möglich sein, kann es in bestimmten Fällen erforderlich sein, die Kombination von Stenteinbringung mit Neuanschluss der renoviszeralen Arterien z.B. an die Beckengefäße im Sinne eines „viszeralen Debranchings“ als Hybridprozedur durchzuführen.
Die hohe Rate an Post-Dissektions-Aneurysmen und hohe Interventionsraten nach Dissektionen im Langzeitverlauf führen zu der Überlegung, welche Patienten von einer TEVAR auch bei akuter, unkomplizierter Dissektion in der subakuten Phase profitieren. Die Literatur beschreibt dabei bestimmte, morphologische, prognostisch ungünstige Faktoren, die letztlich eine früh-präventive TEVAR favorisieren könnten: vorbestehender Aortendurchmesser >40mm, Entry > 10mm, falsches Lumen >22mm, Einriss an der kleinen Kurvatur, fehlende Reentries (Tolenaar JL, van Keulen JW, Jonker FH et al (2013) Morphologic predictors of aortic dilatation in type B aortic dissection. J Vasc Surg 58: 1220-1225).

