Ätiologie
Der Hodenhochstand stellt die häufigste Fehlbildung bei neugeborenen Jungen dar. Bis zum Ende des ersten Lebensjahrs sind noch ca. 1-1,5 % der Knaben betroffen. Die Lage des Hodens im Skrotum ist auf Grund der dort im Vergleich zur Bauchhöhle geringeren Temperatur für die spätere Fertilität von entscheidendem Vorteil. Bleibt ein Hodenhochstand unbehandelt, hat dies neben einer Einschränkung der Fertilität auf Auswirkung auf das Entartungsrlsiko.1,2
Einteilung
Klinisch kann man unterscheiden zwischen Bauchhoden, Leistenhoden, Gleithoden und Hodenektopie. Bei einer Hodenektopie ist der Hoden zwar transinguinal deszendiert, hat aber sein Ziel im unteren Skrotalfach nicht erreicht. Er kann bspw. perineal, an der Peniswurzel, skrotal auf der Gegenseite oder auf der Oberschenkelinnenseite zu finden sein. Ein Gleithoden ist dadurch definiert, dass er sich unter manuellem Zug ins Skrotum verlagern lässt, sich anschließend aber sofort nach kranial retrahiert. Davon abzugrenzen ist ein Pendelhoden. Die ist eine Normvariante, bei der der Hoden reflexartig durch den Kremastermuskel hochgezogen wird. Ein Pendelhoden stellt keine Behandlungsindikation zur, hier muss lediglich regelmäßig die Lage des Hodens im unteren Skrotalfach überprüft werden.
Von einem Kryptorchismus sprich man, wenn der Hoden nicht tastbar ist. In ca. 50% der Fälle findet sich der Hoden dann intraabdominell, in 45 % der Fälle liegt eine Agenesie oder Atrophie vor, man spricht von „vanishing testis". In den übrigen 5% der Fälle liegt der Hoden doch inguinal und ist der initialen Palpation lediglich entgangen. 3
Diagnostik
Die Diagnosestellung des Hodenhochstands erfolgt klinisch. Ein geübter Untersucher und eine geeignete Untersuchungsumgebung sind hier entscheidend. Bei inguinal tastbaren Hoden kann im Zweifelsfall die Sonografie mit einem hochauflösenden Schallkopf helfen, die Diagnose zu bestätigen.
Ist der Hoden nicht zu tasten, hilft weder die Durchführung einer Sonografie noch einer Kernspinntomografie weiter.3 Bei Kryptorchismus ist eine diagnostische Laparoskopie das Verfahren der Wahl, so kann in der Regel zuverlässig ein intraabdominell gelegener Hoden diagnostiziert werden und unmittelbar mit der Behandlung begonnen werden.4
Behandlung
Ein Hodenhochstand bzw. Kryptorchismus stellt eine Behandlungsindikation dar. Hinsichtlich des Zeitraums besteht mittlerweile ein breiter Konsens, dass die Behandlung bis zum Ende des ersten Lebensjahr abgeschlossen sein sollte.5 Dennoch kommt es trotz aller Vorsorgeuntersuchungen immer wieder vor, dass ein Hodenhochstand zu lange unbehandelt bleibt oder der konservativen Therapie zu viel Zeit eingeräumt wird. Bis zum 6. Lebensmonat kann ein Spontandeszensus abgewartet werden. Zwischen dem 6. und 9. Lebensmonat ist eine hormonelle Therapie gerechtfertigt.6
Die Behandlung mit GnRH-Analoga als Nasenspray dient dabei allerdings eher der Reifung der Gonozyten, lediglich in 20% kommt es als Nebeneffekt zu einem Dezensus der Hoden. Die GnRH-Therapie kann also neoadjuvant erfolgen, um die Fertilität zu verbessern.7,8 Kommt es unter diesen Maßnahmen nicht zu einem Deszensus, ist die operative Therapie indiziert, von inguinal bei tastbarem Hoden und laparoskopisch bei Kryptorchismus. Bis zum Ende des ersten Lebensjahrs sollte die Therapie incl. operativer Maßnahmen abgeschlossen sein.
Fertilität
Die Fertilität ist bei einem Hodenhochstand herabgesetzt. Erfassen lässt sich dies durch die Auswertung eines Spermiogramms sowie der Vaterschaften im Langzeitverlauf. Ein einseitiger Hodenhochstand hat dabei bezogen auf die Vaterschaften eine bessere Prognose als ein bilateraler Befund. Systematische Untersuchungen zeigen eine Wahrscheinlichkeit einer Vaterschaft von 80-90 % bei einseitigem Hodenhochstand gegenüber 45-65% bei beidseitigem Vorliegen.9 Die neoadjuvante Gabe von GnRH-Analoga kann die Fertilität verbessern, ein Deszensus lässt sich allerdings nur in 20 % alleine durch eine Hormontherapie erreichen.8
Malignität
Ein nicht deszendierter Hoden stellt ein deutlich erhöhtes Malignitätsrisiko dar. Unbehandelt ist das Entartungsrisiko bis zu fünffach erhöht. Wird der Hodenhochstand bis Eintritt der Pubertät korrigiert, lässt sich dieses Risiko um etwa die Hälfte reduzieren.10,11 Der Grund, dass ein Hodenhochstand bis zum Abschluss des ersten Lebensjahres korrigiert sein sollte, liegt also nicht alleine in der Reduktion des Entartungsrisikos begründet, dieses bleibt auch nach Korrektur erhöht.
Operative Therapie
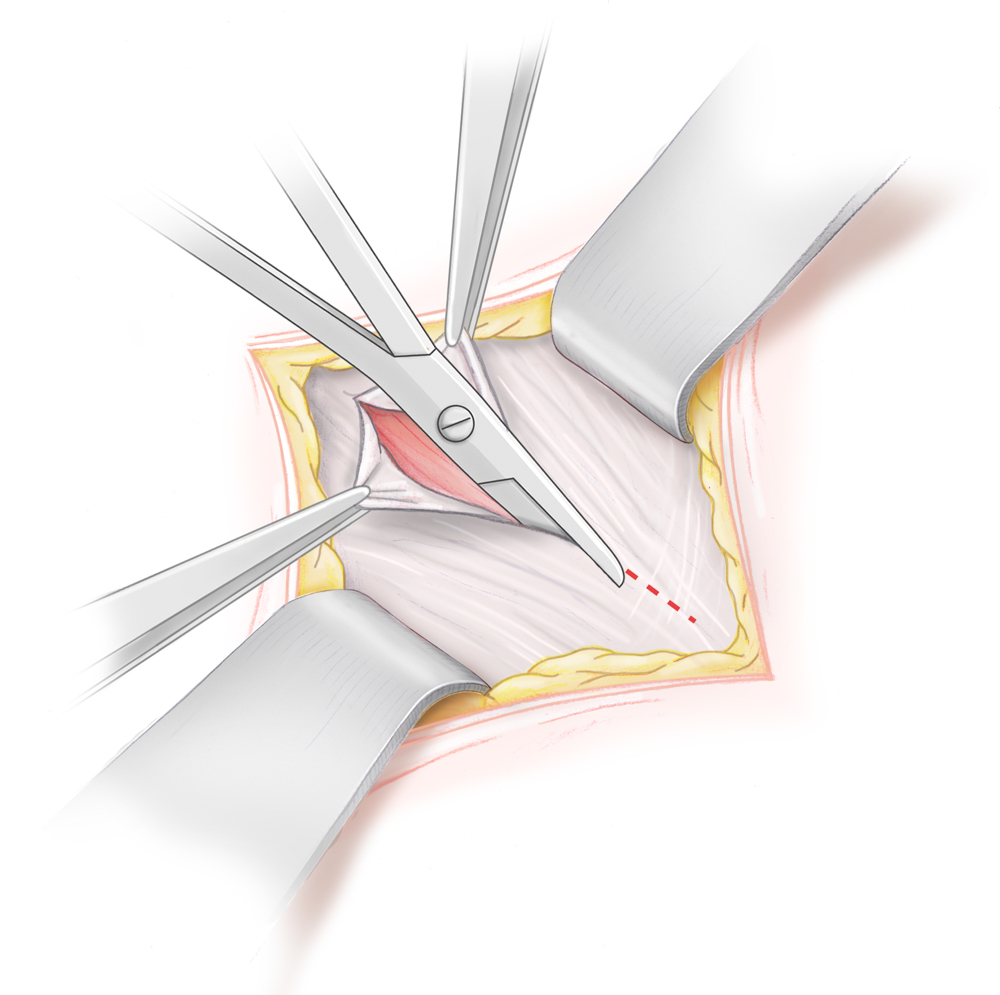
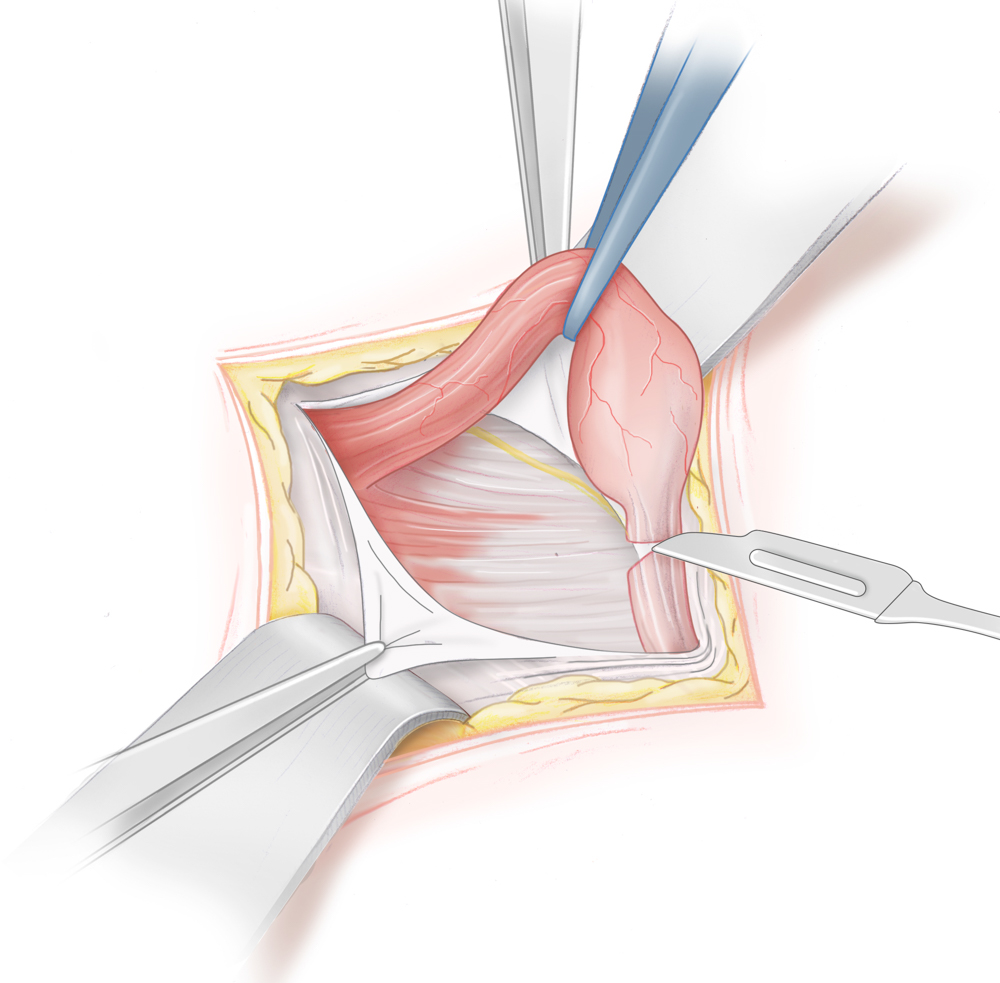
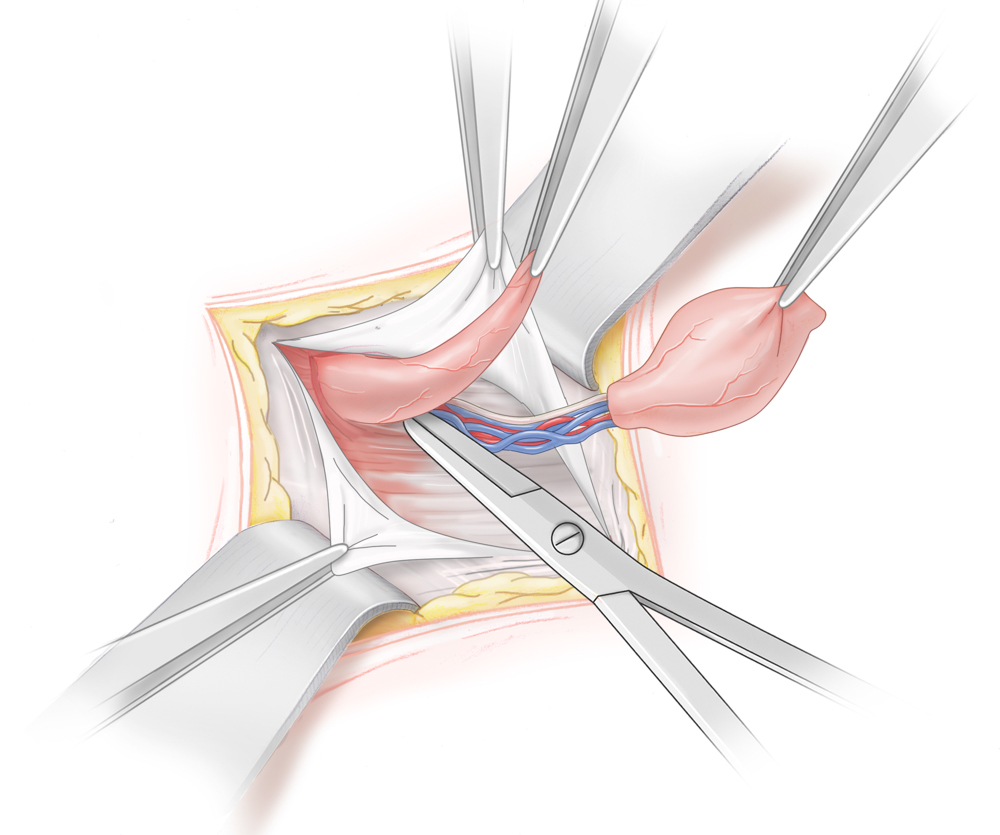
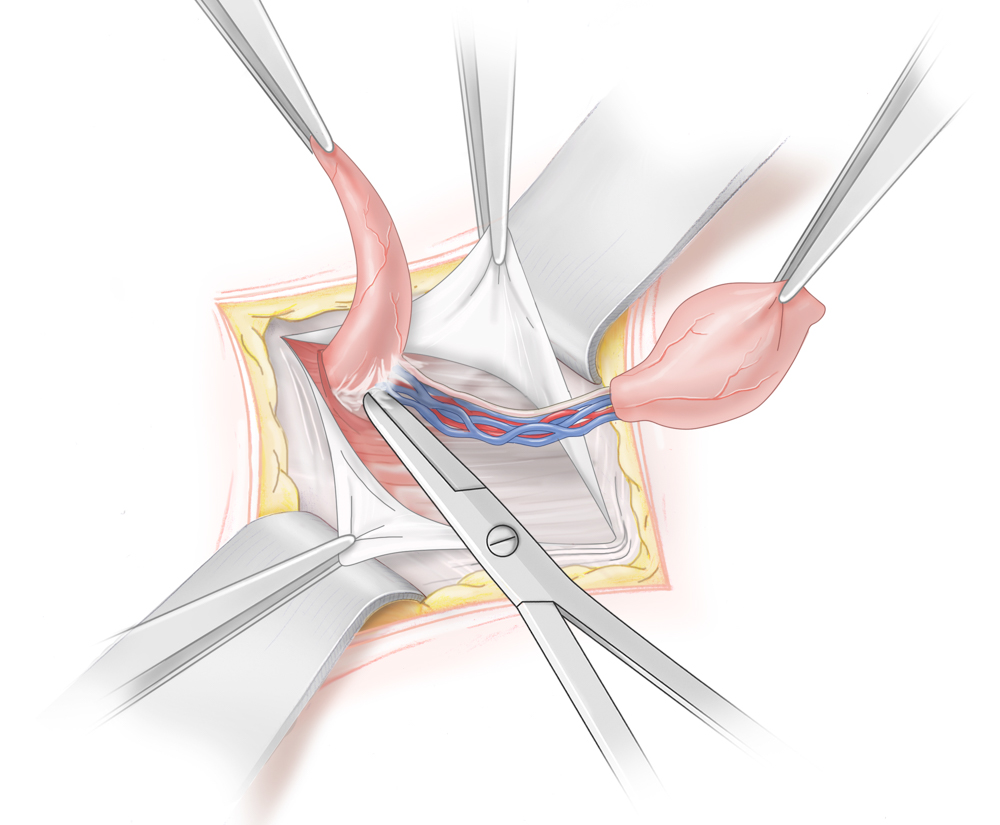
Inguinal tastbare Hoden werden mittels Funikulolyse und Orchidopexie von inguinal operiert, bei nicht tastbarem Hoden besteht die Therapie der Wahl in einer Laparoskopie. So lässt sich zum einen die Diagnose eindeutig stellen und im Falle eines Bauchhodens die Hodenverlagerung durchführen. Gelingt dies auf Grund verkürzter Gefäße primär nicht von inguinal, wird eine sog. Fowler-Stephens-Operation durchgeführt. Hierbei werden die den Hoden versorgenden Gefäße unter Schonung des ductus deferens durchtrennt. Der Hoden kann dann nach inguinal verlagert werden. In der Folge kommt es zu einer kompensatorischen Blutversorgung des Hodens über die A. ductus deferentis, so dass der Hoden in einem zweiten Schritt von inguinal ins untere Skrotalfach verlagert und dort pexiert werden kann.
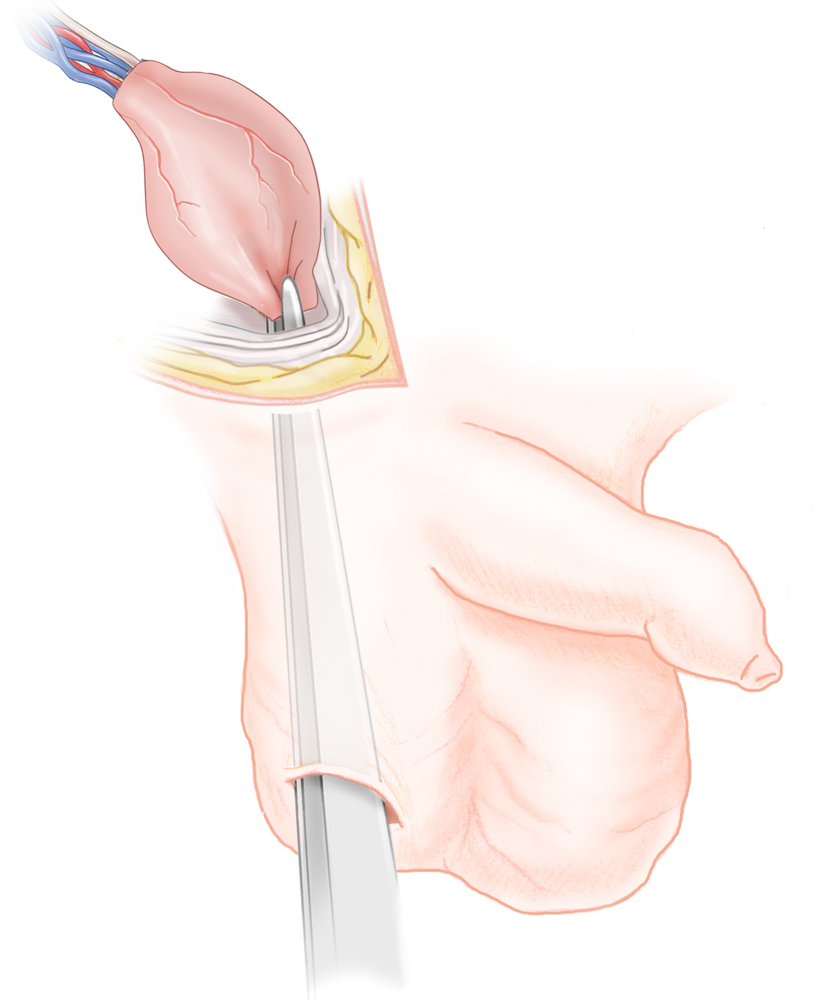
Bei der Funikulolyse und Orchidopexie wird der Hoden von inguinal freigelegt und vom Processus vaginalis abgelöst. Unter Durchtrennung der Kremasterfasern erreicht man eine ausreichende Längenmobilisation, so dass der Hoden ins untere Skrotalfach verlagert werden kann. Hier wird er in einer durch stumpfe Präparation geschaffenen Tasche platziert dort fixiert. Dies geschieht durch die Einengung des Durchtritt in die Tasche.
Als mögliche Komplikationen ist über eine Hodenatrophie, Verlust der Zeugungsfähigkeit sowie einen sekundären Hodenhochstand aufzuklären. Hierunter versteht man ein Zurückbleiben des Hodens hinter dem normalen Längenwachstum des Skrotums. Dies kann durch Narbengewebe induziert werden, bspw. nach einer Leistenhernienoperation beim Neugeborenen oder eben nach eiqer operativen Korrektur eines Hodenhochstandes mittels Funikulolyse und Orchidopexie.
Literatur
- Bujan L, Mieusset R, Mansat A, Moatti JP, Mondinat C, Pontonnier F.
Testicular size in infertile men: relationship to semen characteristics and hormonal blood levels.
Br J Urol. 1989;64(6):632-637. - Cortes D, Thorup JM, Visfeldt J.
Cryptorchidism: aspects of fertility and neoplasms. A study including data of 1,335 consecutive boys who underwent testicular biopsy simultaneously with surgery for cryptorchidism.
Horm Res. 2001;55{l):21-27. - Elder JS.
Ultrasonography is unnecessary in evaluating boys with a nonpalpable testis.
Pec//ofr/cs. 2002;110(4):748-751. - Radmayr C, Dogan HS, Hoebeke P, et al.
Management of undescended testes: European Association of Urology/European Society for Paediatric Urology Guidelines.
JPediatr Urol. 2016;12(6):335-343. - AWMF Leitlinie Hodenhochstand - Maldeszensus testis. Düsseldorf: AWMF; 2008.
- Schmittenbecher PP.
Handlungsempfehlungen nach der S2k-Leitlinie „Hodenhochstand - Maldescensus testis". 2014. - Dickerman Z, Bauman B, Sandovsky U, et al.
Human chorionic gonadotropin (hCG) treatment in cryptorchidism.
Andrologia. 1983;15 Spec No:542-547. - Schwentner C, Oswald J, Kreczy A, et al.
Neoadjuvant gonadotropin-releasing hormone therapy before surgery may improve the fertility index in undescended testes: a prospective randomized trial.
J Urol. 2005;173(3):974-977. - Lee PA, Coughlin MT.
Fertility after bilateral cryptorchidism. Evaluation by paternity, hormone, and semen data.
Horm Res. 2001;55(l):28-32. - Aetiology of testicular cancer: association with congenital abnormalities, age at puberty, infertility, and exercise. United Kingdom Testicular Cancer Study Group.
BMJ. 1994;308(6941):1393-1399. - Pettersson A, Richiardi L, Nordenskjold A, Kaijser M, Akre 0.
Age at surgery for undescended testis and risk of testicular cancer.
N EnglJ Med. 2007;356(18):1835- 1841.

